题目内容
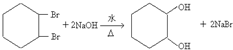
17.由苯和必要的试剂五步可合成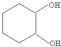 ,其过程如下:
,其过程如下: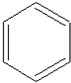 $→_{FeBr_{3}}^{Br_{2}}$A$→_{Ni△}^{H_{2}}$→C→D→
$→_{FeBr_{3}}^{Br_{2}}$A$→_{Ni△}^{H_{2}}$→C→D→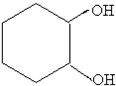
写出后四步反应的方程式:
①
 ;
;②
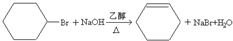 ;
;③
 ;
;④
 .
.
分析 比较苯和 的结构简式及各步的转化关系可知,苯与溴在溴化铁作催化剂的条件下生成溴苯,溴苯与氢气加成得溴代环已烷,溴代环已烷在氢氧化钠醇溶液中发生消去反应得环已烯,环已烯与溴加成得1,2-二溴环已烷,1,2-二溴环已烷再碱性水解得
的结构简式及各步的转化关系可知,苯与溴在溴化铁作催化剂的条件下生成溴苯,溴苯与氢气加成得溴代环已烷,溴代环已烷在氢氧化钠醇溶液中发生消去反应得环已烯,环已烯与溴加成得1,2-二溴环已烷,1,2-二溴环已烷再碱性水解得 ,据此答题;
,据此答题;
解答 解:比较苯和 的结构简式及各步的转化关系可知,苯与溴在溴化铁作催化剂的条件下生成溴苯,溴苯与氢气加成得溴代环已烷,反应方程式为
的结构简式及各步的转化关系可知,苯与溴在溴化铁作催化剂的条件下生成溴苯,溴苯与氢气加成得溴代环已烷,反应方程式为 ,溴代环已烷在氢氧化钠醇溶液中发生消去反应得环已烯,反应方程式为
,溴代环已烷在氢氧化钠醇溶液中发生消去反应得环已烯,反应方程式为 ,环已烯与溴加成得1,2-二溴环已烷,反应方程式为
,环已烯与溴加成得1,2-二溴环已烷,反应方程式为 ,1,2-二溴环已烷再碱性水解得
,1,2-二溴环已烷再碱性水解得 ,反应方程式为
,反应方程式为 ,
,
故答案为: ;
; ;
; ;
; .
.
点评 本题考查有机物的合成,为高频考点,把握有机物官能团与性质的关系及合成流程中发生的化学反应为解答的关键,注意结构、官能团变化,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
7.下列有机物的命名及名称书写均正确的是( )
| A. | CH2Br-CH2Br 二溴乙烷 | B. | CH3CH(NH2)CH2COOH 3-氨基丁酸 | ||
| C. | 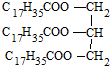 硬脂酸甘油脂 硬脂酸甘油脂 | D. | 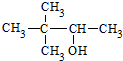 2,2-二甲基-3-丁醇 2,2-二甲基-3-丁醇 |
5.下列的结构简式正确的是( )
| A. | CH3COH | B. | CH3CH2OH | C. | HO-CH3CH3-OH | D. | CH2CH2 |
12.某盐酸试剂瓶上的标签如图.下列有关说法正确的为( )


| A. | 该浓度的盐酸可以用广口瓶盛装 | |
| B. | 该试剂的物质的量浓度为11.9mol/L | |
| C. | 用该盐酸配制250毫升2.0摩尔、升的稀盐酸时需要选用100毫升量筒 | |
| D. | 该盐酸中所含Cl-数目为5.95NA |
2.对下列实验现象的原因分析不正确的一项是( )
| 选项 | 实验现象 | 原因分析 |
| A | 浓硫化钠溶液有臭味 | 硫离子水解生成硫化氢,硫化氢具有臭味 |
| B | 新制氯水中滴加石蕊试液,溶液先变红,后褪色 | 氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 |
| C | SO 2通入溴水中,溴水褪色 | SO 2具有漂白性,使其褪色 |
| D | 向饱和Na2CO3溶液中通入足量CO2气体,溶液变浑浊 | 析出了NaHCO3晶体 |
| A. | A | B. | B | C. | C | D. | D |
9.下列有关物质性质的比较顺序中,不正确的是( )
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+>Al3+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | D. | 第一电离能:Na<Mg<Al<Si |
6.某原电池总反应的离子方程式为 2Fe3++Fe=3Fe2+,能实现该反应的原电池是( )
| A. | 正极为 Cu,负极为 Fe,电解质为 FeCl3 溶液 | |
| B. | 正极为Fe,负极为Zn,电解质为 Fe(NO3)3 溶液 | |
| C. | 正极为 Fe,负极为 Zn,电解质为 FeSO4 溶液 | |
| D. | 正极为 Ag,负极为 Fe,电解质为 CuSO4 溶液 |
 A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.
A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,并能进行如图所示的多种反应.