题目内容
2.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 常温常压下,0.2NA个NH3分子的质量为3.4g | |
| B. | 2.7g金属铝所含电子数目为0.3NA | |
| C. | 7.1 g Cl2变为氯离子时,得到的电子数一定为0.1NA | |
| D. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-离子数目为0.2NA |
分析 A、求出氨气的物质的量,然后根据质量m=nM来分析;
B、求出铝的物质的量,然后根据1mol铝含13mol电子来分析;
C、求出氯气的物质的量,然后根据氯气变为氯离子时,1mol氯气得2mol电子来分析;
D、求出硫酸铁的物质的量,然后根据1mol硫酸铁中含3mol硫酸根来分析.
解答 解:A、0.2NA个氨气分子的物质的量为0.2mol,而质量m=nM=0.2mol×17g/mol=3.4g,故A正确;
B、2.7g铝的物质的量为0.1mol,而1mol铝含13mol电子,故0.1mol铝含1.3NA个电子,故B错误;
C、7.1g氯气即0.1mol氯气,由于变为氯离子后变为-1价,故0.1mol氯气得0.2NA个电子,故C错误;
D、溶液中硫酸铁的物质的量n=CV=0.2mol/L×1L=0.2mol,而1mol硫酸铁中含3mol硫酸根,故0.2mol硫酸铁中含0.6NA个硫酸根,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
12.铁在工业和生活中都具有非常重要的应用.某含铁化合物W,为探究其成分,化学兴趣小组的同学取化合物W粉末进行试验.经组成分析,该粉末除Fe外还有O和另一未知元素共三种元素.另取2.22g化合物W的粉末溶于适量稀硫酸,向反应后的溶液中加入含有3.20gNaOH的溶液,恰好完全反应.过滤,将洗涤后的沉淀充分灼烧,得到红棕色粉末1.60g;将所得滤液在一定条件下蒸发灼烧可得到一种纯净的不含结晶水的盐7.10g.请回答:
(1)则另一未知元素为Na(填化学式).
(2)①该化合物W的化学式为NaFeO2.
②该化合物W与适量稀硫酸反应的化学方程式2NaFeO2+4H2SO4=Na2SO4+Fe2(SO4)3+4H2O.
(3)草酸钴是广泛应用于磁性材料、电池材料、及超硬材料等领域.某研究小组在实验室探究CoC2O4分解反应的平衡常数.将一定量纯净的CoC2O4粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解的平衡:
CoC2O4(S)?CoO(S)+CO(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
由表中数据,列式计算250℃时CoC2O4分解平衡常数2.89×10-6. 该反应的焓变△H>0(填“>”、“=”或“<”).
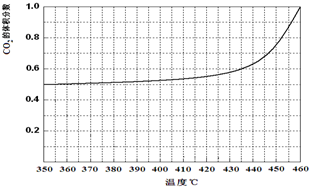
(4)温度加热至350℃,CO2的体积分数开始发生变化,体积分数和温度的关系如下:
试画出CO的体积分数随温度升高的曲线
(1)则另一未知元素为Na(填化学式).
(2)①该化合物W的化学式为NaFeO2.
②该化合物W与适量稀硫酸反应的化学方程式2NaFeO2+4H2SO4=Na2SO4+Fe2(SO4)3+4H2O.
(3)草酸钴是广泛应用于磁性材料、电池材料、及超硬材料等领域.某研究小组在实验室探究CoC2O4分解反应的平衡常数.将一定量纯净的CoC2O4粉末置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解的平衡:
CoC2O4(S)?CoO(S)+CO(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
| 温度/℃ | 240 | 250 | 260 | 270 |
| 平衡总压强/kp | 5.7 | 8.3 | 12.0 | 17.1 |
| 平衡总浓度/mol•L-1 | 2.4×10-3 | 3.4×10-3 | 4.8×10-3 | 6.8×10-3 |
(4)温度加热至350℃,CO2的体积分数开始发生变化,体积分数和温度的关系如下:
试画出CO的体积分数随温度升高的曲线

17.下列元素的原子既可以通过离子键,又可以通过共价键形成二元化合物的是( )
| A. | K | B. | Ca | C. | I | D. | Ne |
7.蓝宝石的主要成分为第ⅢA族某元素的氧化物,关于该氧化物的描述正确的是( )
| A. | 该氧化物为Fe2O3 | |
| B. | 该氧化物具有较高的熔点 | |
| C. | 该氧化物易溶于水 | |
| D. | 该氧化物能与强酸反应,但不能与强碱反应 |
14.关于氨的下列叙述中,错误的是( )
| A. | 氨易液化,因此可用来作制冷剂 | B. | 氨水显弱碱性,能使酚酞溶液变红 | ||
| C. | 氨极易溶于水,因此氨水比较稳定 | D. | 氨极易溶于水,因此可作喷泉实验 |
11.设NA为阿伏伽德罗常数的值,下列叙述中正确的是( )
| A. | 1mol/L Na2CO3溶液中,阴离子个数等于NA | |
| B. | 标准状况下,22.4L正戊烷完全燃烧产生5NA个CO2分子 | |
| C. | 乙烯和丙烯的混合气体14g中,含有的共价键数目为3 NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.2 NA |
12.下列说法正确的是( )
| A. | 任何化学反应都伴随能量变化 | |
| B. | 化学反应中的能量变化都表现为热量的变化 | |
| C. | CH4的完全燃烧过程中放出热量,属于放热反应,即反应物的总能量低于生成物的总能量 | |
| D. | Ba(OH)2•8H2O与NH4Cl反应过程中吸收热量,属于吸热反应,即反应物的总能量高于生成物的总能量 |