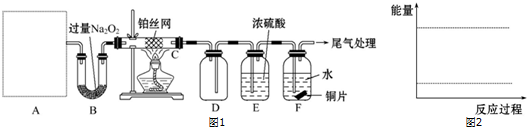
题目内容
14.关于氨的下列叙述中,错误的是( )| A. | 氨易液化,因此可用来作制冷剂 | B. | 氨水显弱碱性,能使酚酞溶液变红 | ||
| C. | 氨极易溶于水,因此氨水比较稳定 | D. | 氨极易溶于水,因此可作喷泉实验 |
分析 A.氨气沸点高,易液化,液态氨气汽化吸收大量的热;
B.氨水中含有一水合氨,一水合氨电离产生氢氧根离子;
C.依据一水合氨的不稳定性解答;
D.根据喷泉实验产生的原理:气体极易溶于液体或是气体极易和液体碱反应,导致气压差出现;
解答 解:A.氨气沸点高,易液化,液态氨气汽化吸收大量的热,所以可用来作制冷剂,故A正确;
B.氨水中含有一水合氨,一水合氨电离产生氢氧根离子,所以溶液呈碱性,能够使酚酞溶液变红,故B正确;
C.一水合氨的不稳定性,受热分解生成氨气和水,故C错误;
D.NH3都极易溶于水导致气压差出现,符合喷泉实验产生的条件,故D正确;
故选:C.
点评 本题考查了氨气的性质,熟悉氨气的物理性质和化学性质是解题关键,注意喷泉实验的原理.

练习册系列答案
相关题目
5.下列实验不能达到预期目的是( )
| A | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| B | MgCl2、Al Cl3溶液中分别通入NH3 | 比较镁、铝的金属性强弱 |
| C | NaCO3溶液中加入稀H2SO4 | 比较碳、硫的非金属性强弱 |
| D | Fe、Cu分别与盐酸反应 | 比较铁、铜的金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
2.设NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,0.2NA个NH3分子的质量为3.4g | |
| B. | 2.7g金属铝所含电子数目为0.3NA | |
| C. | 7.1 g Cl2变为氯离子时,得到的电子数一定为0.1NA | |
| D. | 1L 0.2mol/L硫酸铁溶液中含有的SO42-离子数目为0.2NA |
19.下列物质见光不会分解的是( )
| A. | HClO | B. | AgNO3 | C. | HNO3 | D. | NH4Cl |
6.下列有机物的命名正确的是( )
| A. | 二溴乙烷: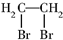 | B. | 3-乙基-1-丁烷: | ||
| C. | 2,2,3-三甲基戊烷: | D. | 2-甲基-2,4-己二烯: |
4.现有部分短周期元素的原子结构如表:
(1)写出X的元素符号:N,元素Y的最简单氢化物的化学式为CH4.
(2)Z元素原子的质量数为23.
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为H++OH-=H2O.
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式2CO2+2Na2O2=2Na2CO3+O2
(5)W、X、Y、Z为短周期内除稀有气体元素外的四种元素.它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W最外层电子数相等,Y、Z两元素的质子数之和为W、X两元素的质子数之和的3倍.由此可知元素W为H;X为O;Y 为Na;Z为S.上述元素中任意三种可组成盐,写出这些盐的化学式Na2SO4、Na2SO3、Na2S2O3、NaHS.
| 元素符 号 | 元素原子结构 |
X | 原子结构示意图为 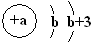 |
| Y | 最外层电子数是次外层电子数的2倍 |
Z | 原子核内含有12个中子,且其离子的结构示意图为  |
(2)Z元素原子的质量数为23.
(3)X和Z两种元素的最高价氧化物对应的水化物相互反应的离子方程式为H++OH-=H2O.
(4)Y和Z两种元素的最高价氧化物发生氧化还原反应的化学方程式2CO2+2Na2O2=2Na2CO3+O2
(5)W、X、Y、Z为短周期内除稀有气体元素外的四种元素.它们的原子序数依次增大,其中只有Y是金属元素,Y的最外层电子数和W最外层电子数相等,Y、Z两元素的质子数之和为W、X两元素的质子数之和的3倍.由此可知元素W为H;X为O;Y 为Na;Z为S.上述元素中任意三种可组成盐,写出这些盐的化学式Na2SO4、Na2SO3、Na2S2O3、NaHS.