题目内容
18.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K′,则K′与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{K}$
(2)下列各项能说明合成氨反应已达到平衡状态的是c(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用Cu(NH3)2Ac溶液来吸收原料气中的CO,其反应是:Cu(NH3)2Ac+CO+NH3?[Cu(NH3)3]Ac•CO△H<0,生产中必须除去原料气中CO的原因是防止合成塔中的催化剂中毒;Cu(NH3)2Ac溶液吸收原料气中的CO的生产适宜条件应是低温、高压.
分析 (1)①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小;
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),相同温度下其平衡常数为N2(g)+3H2(g)?2NH3(g)的平衡常数平方根;
(2)可逆反应到达平衡时,同一物质的正、逆反应速率相等,各组分的浓度、含量不变,由此衍生的其它一些物理量不变,注意判断平衡状态的物理量应随反应进行而变化,该物理量由变化到不变化,说明反应到达平衡;
(3)CO可以使合成塔中催化剂中毒,需要除去;
吸收CO的正反应为气体体积减小的放热反应,在低温、高压下有利于CO的吸收.
解答 解:(1)①因该反应是放热反应,反应随着温度的升高,平衡逆向移动,故K1>K2,
故答案为:>;
②$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g)的平衡常数K′=$\frac{c(N{H}_{3})}{{c}^{\frac{1}{2}}({N}_{2}){×c}^{\frac{3}{2}}({H}_{2})}$,N2(g)+3H2(g)?2NH3(g)的平衡常数K=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})×{c}^{3}({H}_{2})}$,故K′=$\sqrt{K}$,
故选:D;
(2)a.容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,与物质的起始浓度及转化率有关,故a错误;
b.不同物质的正、逆反应速率之比等于其计量数之比是平衡状态,故b错误;
c.容器内压强不变,则气体的物质的量不变,该反应达平衡状态,故c正确;
d.如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故d错误;
故选:c;
(3)生产中必须除去原料气中CO的原因是:防止合成塔中的催化剂中毒,
吸收CO的正反应为气体体积减小的放热反应,在低温、高压下有利于CO的吸收.
故答案为:防止合成塔中的催化剂中毒;低温、高压.
点评 本题考查化学平衡产生及其影响因素、平衡状态判断、平衡原理的应用等,侧重对学生分析与应用能力的考查,注意平衡常数及其单位与化学计算量有关,题目难度中等.

| A. | 150mL 1 mol/L氯化钠溶液 | B. | 75mL 2 mol/L氯化镁溶液 | ||
| C. | 50mL 3 mol/L氯化钾溶液 | D. | 50mL 1 mol/L氯化铁溶液 |
| A. | 肯定不存在的离子是Fe3+、Cu2+、NH4+、SO42-、CO32-、MnO4- | |
| B. | 肯定存在的离子是SO32-、Br-;Na+、K+离子至少有一种存在 | |
| C. | 无法确定原溶液中是否存在Cl- | |
| D. | 若步骤④改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断有影响. |
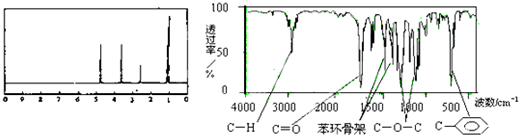
| A. | A分子属于酯类化合物,在一定条件下能发生水解反应 | |
| B. | 符合题中A分子结构特征的有机物有两种 | |
| C. | A在一定条件下可与3 mol H2发生加成反应 | |
| D. | 分子式为C8H8O2且分子中含苯环和-COOR(-R为烃基)的物质共有6种 |
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 能量是可以互相转化的.植物的光合作用可将太阳能转变成化学能,单晶硅可将光能转变成电能.原电池和电解池可实现化学能和电能的相互转换 | |
| C. | 分类方法、统计方法、定量研究、实验方法和模型化方法等是化学研究的常用方法 | |
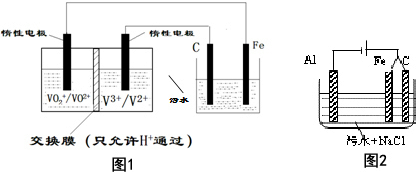
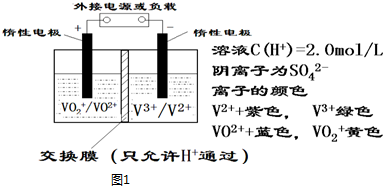
| D. | 利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 |
 A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):
A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去): .
.