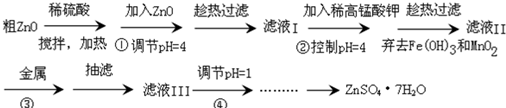
题目内容
10. A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):
A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):(1)若所有转化都是非氧化还原反应,B、D、E含有同种金属元素,F为强碱(部分产物略去)
则A+B→C+D的离子反应式为4H++AlO2-=Al3++2H2O,C为同周期元素构成的1:1型化合物,则C的电子式为
 .
.(2)若A、D、F 为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,则E的化学式为CO,
A+B→C+D的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
分析 (1)F为强碱(部分产物略去),则F为NaOH,若所有转化都是非氧化还原反应,B、D、E含有同种金属元素,结合转化关系可知,B为NaAlO2,D为AlCl3,E为Al(OH)3,A为HCl,C为NaCl;
(2)若A、D、F为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,反应A+B→C+D属于置换反应,D应为非金属单质,Mg与二氧化碳的反应符合,结合转化关系可知,A为Mg,B为CO2,C为MgO,D为碳,F为O2,E为CO.
解答 解:(1)F为强碱(部分产物略去),则F为NaOH,若所有转化都是非氧化还原反应,B、D、E含有同种金属元素,结合转化关系可知,B为NaAlO2,D为AlCl3,E为Al(OH)3,A为HCl,C为NaCl,A+B→C+D的离子反应式为4H++AlO2-=Al3++2H2O,C的电子式为 ,
,
故答案为:4H++AlO2-=Al3++2H2O; ;
;
(2)若A、D、F为单质,B、C、E为化合物,B为两种非金属元素所组成的化合物,反应A+B→C+D属于置换反应,D应为非金属单质,Mg与二氧化碳的反应符合,结合转化关系可知,A为Mg,B为CO2,C为MgO,D为碳,F为O2,E为CO,A+B→C+D的化学方程式为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$ 2MgO+C,
故答案为:CO;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$ 2MgO+C.
点评 本题考查无机物推断,题目没有明显的突破口,充分根据转化关系中特殊反应及有关信息推断,需要学生熟练掌握元素化合物知识,难度较大.

练习册系列答案
相关题目
20.丁香油酚的结构简式为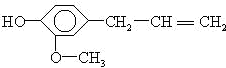 据此结构分析,下列说法正确的是( )
据此结构分析,下列说法正确的是( )
 据此结构分析,下列说法正确的是( )
据此结构分析,下列说法正确的是( )| A. | 可以燃烧,只能与溴水发生加成反应 | |
| B. | 可与NaOH溶液反应,也可与FeCl3溶液反应 | |
| C. | 不能与金属钠反应放出H2 | |
| D. | 可以与小苏打溶液反应放出CO2气体 |
18.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
①试判断K1> K2(填写“>”“=”或“<”).
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K′,则K′与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{K}$
(2)下列各项能说明合成氨反应已达到平衡状态的是c(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用Cu(NH3)2Ac溶液来吸收原料气中的CO,其反应是:Cu(NH3)2Ac+CO+NH3?[Cu(NH3)3]Ac•CO△H<0,生产中必须除去原料气中CO的原因是防止合成塔中的催化剂中毒;Cu(NH3)2Ac溶液吸收原料气中的CO的生产适宜条件应是低温、高压.
(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K′,则K′与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{K}$
(2)下列各项能说明合成氨反应已达到平衡状态的是c(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用Cu(NH3)2Ac溶液来吸收原料气中的CO,其反应是:Cu(NH3)2Ac+CO+NH3?[Cu(NH3)3]Ac•CO△H<0,生产中必须除去原料气中CO的原因是防止合成塔中的催化剂中毒;Cu(NH3)2Ac溶液吸收原料气中的CO的生产适宜条件应是低温、高压.
5.下列说法不正确的是( )
| A. | 利用二氧化碳制造全降解塑料,可以缓解温室效应 | |
| B. | 用电化学方法可在常温常压条件下合成氨,也可以用电解法精炼铜 | |
| C. | 检测NaClO、KMnO4等具有强氧化性物质溶液的PH时,最好选用PH计 | |
| D. | 纤维素经水解、发酵后可制得乙醇和少量甲醇,所得乙醇和甲醇的热值相同 |
15.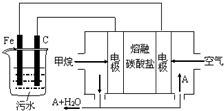 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
2.下列说法不正确的是( )
| A. | 熟石灰与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| B. | 人造纤维是利用自然界的非纤维材料通过化学合成方法得到的 | |
| C. | 雾霾是一种分散系,分散剂是空气,带活性炭口罩防雾霾的原理是吸附原理 | |
| D. | 利用二氧化碳等原料合成的聚碳酸酯类可降解塑料替代聚乙烯塑料,可减少“白色污染” |
19.在一定温度下,向容积为2L的密闭容器中充入一定量的CO和NO2发生反应:4CO(g)+2NO2(g)?N2(g)+4CO2(g)△H<0.有关该反应的描述正确的是( )


| A. | 在一定温度、固定容积的密闭容器里,混合气体的密度不再改变可以说明上述可逆反应已达平衡 | |
| B. | 由图1可得加入适当的催化剂,E减小,△H 增大 | |
| C. | 图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1<T2,K1<K2 | |
| D. | 图2中0~10min内该反应的平均速率v(CO)=0.03mol•L-1•min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(NO2)的变化曲线为d |
20.下列实验目的可以实现或操作正确的是( )
| A. | 用50mL的量筒量取45.50mL的水 | |
| B. | 将40gNaOH溶解于1L水中配得1mol/L的溶液 | |
| C. | CCl4萃取碘水的实验中,分液时,水层液体从下口流出 | |
| D. | 稀释浓硫酸时,把浓硫酸沿器壁慢慢注入水里,并不断搅拌 |