题目内容
6.电解法处理污水已经得到广泛的应用.若负载是酸性介质中将有毒的Cr2O72-转变为Cr3+的电解池.装置如图1所示,请用文字描述其工作原理阳极的金属铁放电得到的亚铁离子将Cr2O72-还原为Cr3+.若负载是进行三电极法污水处理的电解池原理如图2所示,增加的铁电极的可能作用是产生促使污物聚沉的Fe(OH)3.
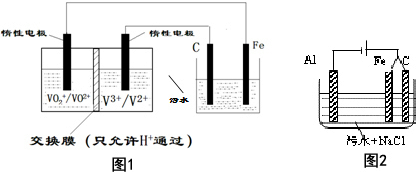
分析 Fe作阳极失电子生成Fe2+,Fe2+把Cr2O72-还原为Cr3+;图2中阴极上生成氢氧根离子,阳极生成亚铁离子,二者结合生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,能使污物聚沉.
解答 解:酸性介质中将有毒的Cr2O72-转变为Cr3+,需要加入还原剂,则Fe作阳极失电子生成Fe2+,Fe2+具有还原性,把Cr2O72-还原为Cr3+;
图2中电解质为氯化钠溶液,电解时在阴极上生成氢氧根离子,阳极上Fe失电子生成亚铁离子,二者结合生成氢氧化亚铁,氢氧化亚铁被氧气氧化为氢氧化铁,Fe(OH)3能使污物聚沉;
故答案为:阳极的金属铁放电得到的亚铁离子将Cr2O72-还原为Cr3+;产生促使污物聚沉的Fe(OH)3.
点评 本题考查了电解原理的应用,明确原电池和电解池原理是解本题关键,知道离子的放电顺序,注意Cr2O72-转变为Cr3+过程中需要还原剂,题目难度不大.

练习册系列答案
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案
相关题目
16.关于胶体和溶液的叙述中正确的是( )
| A. | 胶体带电荷,而溶液呈电中性 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 胶体是一种介稳性的分散系,而溶液是一种非常稳定的分散系 | |
| D. | 胶体能够发生丁达尔现象是因为光的反射 |
17.已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=-1 452kJ•mol-1
H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列说法正确的是( )
| A. | H2(g)的燃烧热为571.6 kJ•mol-1 | |
| B. | 0.5H2SO4(aq)+0.5Ba(OH)2(aq)═0.5BaSO4(s)+H2O(l)△H=-57.3 kJ•mol-1 | |
| C. | 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 | |
| D. | 3H2(g)+CO2(g)═CH3OH(l)+H2O(l)△H=+131.4 kJ•mol-1 |
14.2015年2月28日,前央视记者柴静推出了她自费拍摄的雾霾深度调查《穹顶之下》,纪录片中阐述了“雾霾是什么,它从哪里来,我们该怎么办”三个问题,下面有关叙述正确的是( )
| A. | PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重.因此由PM2.5引起的雾霾一定属于气溶胶 | |
| B. | 纪录片中详细阐述了煤的大量燃烧是产生雾霾的主要原因,如果使用前对煤进行脱硫处理,可减少二氧化硫的排放;石膏法脱硫工艺是一种常用的脱硫技术 | |
| C. | 汽车尾气中的氮氧化物和碳氢化合物在大气环境中受强烈的太阳紫外线照射后产生一种新的二次污染物--光化学烟雾也会引起雾霾,汽车尾气中含有氮氧化物,原因是汽油燃烧不充分 | |
| D. | 多植树造林,使用“乙醇汽油”,改燃煤为燃气,外出时使用PM2.5的口罩等都是治理“雾霾”等灾害性天气的有效措施 |
11.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称为2,4 一二乙基-6-丙基辛烷 的名称为2,4 一二乙基-6-丙基辛烷 | |
| B. | 月桂烯 ( )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通入苯酚钠溶液,苯酚钠溶液中出现白色浑浊,说明酸性:醋酸>碳酸>苯酚 | |
| D. | 在盛有试粉溶液的试管中加入70%的硫酸边搅拌边加热5分钟,冷却至室温,再加入氢氧化钠中和至碱性.加入银氨溶液水浴加热,产生银镜.说明淀粉水解能产生还原性糖 |
18.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
①试判断K1> K2(填写“>”“=”或“<”).
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K′,则K′与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{K}$
(2)下列各项能说明合成氨反应已达到平衡状态的是c(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用Cu(NH3)2Ac溶液来吸收原料气中的CO,其反应是:Cu(NH3)2Ac+CO+NH3?[Cu(NH3)3]Ac•CO△H<0,生产中必须除去原料气中CO的原因是防止合成塔中的催化剂中毒;Cu(NH3)2Ac溶液吸收原料气中的CO的生产适宜条件应是低温、高压.
(1)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
②如果合成氨反应的方程式写为$\frac{1}{2}$N2(g)+$\frac{3}{2}$H2(g)?NH3(g),其平衡常数为K′,则K′与K的关系为D(填字母)
A.K′=K B.K′=2K C.K′=$\frac{1}{2}$K D.K′=$\sqrt{K}$
(2)下列各项能说明合成氨反应已达到平衡状态的是c(填字母)(反应是在固定体积的密闭容器中进行的)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)(正)=3v(H2)(逆)
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用Cu(NH3)2Ac溶液来吸收原料气中的CO,其反应是:Cu(NH3)2Ac+CO+NH3?[Cu(NH3)3]Ac•CO△H<0,生产中必须除去原料气中CO的原因是防止合成塔中的催化剂中毒;Cu(NH3)2Ac溶液吸收原料气中的CO的生产适宜条件应是低温、高压.
15.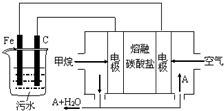 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.下列说法正确的是( )| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
16. 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
 25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol•L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH 的关系如图所示.下列有关溶液中离子浓度关系的叙述正确的是( )| A. | Y点所表示的溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) | |
| B. | W点所表示的溶液中:c(Na+)+c(H+)+c(OH-)+c(CH3COOH)=0.1mol•L-1 | |
| C. | 该温度下醋酸的电离平衡常数为10-1 mol•L-1 | |
| D. | 向X点所表示的溶液中加入等体积的0.05 mol•L-1 NaOH溶液:c(H+)=c(CH3COOH)+c(OH-) |
