题目内容
20.由下列反应式所得出的结论中正确的是( )| A. | NH3+H3O+═NH${\;}_{4}^{+}$+H2O:NH3结合H+的能力比H2O强 | |
| B. | Al2O3+2NaOH═2NaAlO2+H2O:Al2O3是两性氧化物 | |
| C. | HClO+SO2+H2O═HCl+H2SO4:酸性 HClO>H2SO4 | |
| D. | 已知C(s,石墨)=C(s,金刚石)△H=+1.9 kJ/mol:金刚石比石墨稳定 |
分析 A.由离子反应可知,氨气易结合氢离子;
B.通过反应Al2O3+2NaOH═2NaAlO2+H2O只能说明氧化铝为酸性氧化物,无法判断为碱性氧化物;
C.该反应为氧化还原反应,无法证明次氯酸和硫酸的酸性强弱;
D.物质具有的能量越高,物质的稳定性越弱.
解答 解:A.由NH3+H3O+═NH4++H2O可知,得质子能力:NH3>H2O,即NH3结合H+的能力比H2O强,故A正确;
B.证明Al2O3是两性氧化物,必须证明氧化铝既能够与酸反应,又能够与碱反应,该反应只能证明氧化铝为酸性氧化物,故B错误;
C.HClO+SO2+H2O═HCl+H2SO4为氧化还原反应,二氧化硫被次氯酸氧化成硫酸,无法判断次氯酸和硫酸的酸性强弱,故C错误;
D.由C(石墨,s)═C(金刚石,s)△H=+1.9 kJ/mol可知该反应为吸热反应,说明金刚石的能量大于石墨,则石墨比金刚石稳定,故D错误;
故选A.
点评 本题考查较为综合,涉及两性氧化物、酸性强弱判断、物质稳定性与能量大小的关系等知识,题目难度中等,B为易错点,注意该反应只能证明氧化铝为酸性氧化物,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
8.设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A. | 5.6 g铁与足量稀硝酸反应,转移电子的数目为0.2 NA | |
| B. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| C. | 8.8g乙酸乙酯中含共用电子对数为1.4 NA | |
| D. | 1 L 0.1 mol•L-1氯化铜溶液中铜离子数为0.1 NA |
15. 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )
 乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,在制备乙醛的同时能获得电能,其总反应为:2CH2═CH2+O2→2CH3CHO.下列有关说法不正确的是( )| A. | 该电池可将化学能转化为电能 | |
| B. | 每有0.1 mol O2反应,则迁移0.4 mol H+ | |
| C. | 正极反应式为:CH2=CH2-2e-+2OH-═CH3CHO+H2O | |
| D. | 负极区溶液的pH减小 |
12.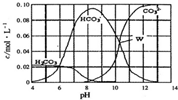 25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
 25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A. | W点所示的溶液中:c(Na+)+c(H+)=4c(CO32-)+c(OH-)+c(Cl-) | |
| B. | pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol/L | |
| C. | pH=8的溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
10.铝土矿为自然界中铝的重要存在形式,通常含有50%左右的Al2O3,以及SiO2、Fe2O3和MgO等成分.上述4种氧化物中,属于两性氧化物的是( )
| A. | Al2O3 | B. | SiO2 | C. | Fe2O3 | D. | MgO |
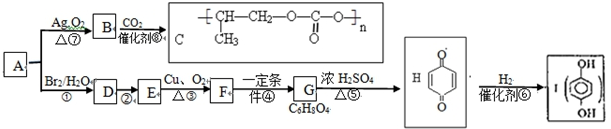
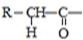 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$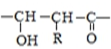
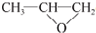 ;⑤的反应类型是消去反应.
;⑤的反应类型是消去反应.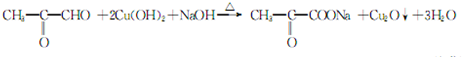 ;
;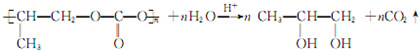 .
.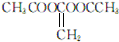 或
或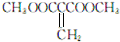 )(任写两种)
)(任写两种)