题目内容
10.铜是人类最早利用的金属之一.(1)“湿法炼铜”的原理是硫酸铜溶液与铁反应,该反应的化学方程式为Fe+CuSO4=Cu+FeSO4.
(2)利用废旧电池铜帽(含 Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液,主要流程如下(反应条件已略去):
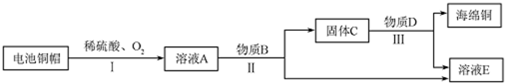
已知:2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O
①过程Ⅱ中分离操作的名称是过滤.
②过程Ⅲ中有气体产生,反应的化学方程式为Zn+H2SO4=ZnSO4+H2↑.
③A~E中含铜、锌两种元素的物质有AC(填字母序号).
分析 (1)硫酸铜溶液与铁反应,生成硫酸亚铁和Cu;
(2)由实验流程可知,I中发生2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O、Zn+H2SO4=ZnSO4+H2↑,溶液A中含CuSO4、ZnSO4,Ⅱ中发生Zn+CuSO4=ZnSO4+Cu,则物质B为Zn,溶液E为ZnSO4溶液,固体C中含Zn、Cu,物质D为稀硫酸,Ⅲ中发生Zn+H2SO4=ZnSO4+H2↑,过滤得到Cu和溶液E,以此来解答.
解答 解:(1)硫酸铜溶液与铁反应,生成硫酸亚铁和Cu,化学反应方程式为Fe+CuSO4=Cu+FeSO4,故答案为:Fe+CuSO4=Cu+FeSO4;
(2)由实验流程可知,I中发生2Cu+2H2SO4+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuSO4+2H2O、Zn+H2SO4=ZnSO4+H2↑,溶液A中含CuSO4、ZnSO4,Ⅱ中发生Zn+CuSO4=ZnSO4+Cu,则物质B为Zn,溶液E为ZnSO4溶液,固体C中含Zn、Cu,物质D为稀硫酸,Ⅲ中发生Zn+H2SO4=ZnSO4+H2↑,过滤得到Cu和溶液E,
①过程Ⅱ中分离不溶于固体与溶液,则分离操作的名称是过滤,故答案为:过滤;
②过程Ⅲ中有气体产生,反应的化学方程式Zn+H2SO4=ZnSO4+H2↑,故答案为:Zn+H2SO4=ZnSO4+H2↑;
③由上述实验流程分析可知,A、C中物质含铜、锌两种元素,故答案为:AC.
点评 本题考查混合物分离提纯及物质的性质,为高频考点,把握实验流程、发生的反应、混合物分离提纯等为解答的关键,侧重分析与实验能力的考查,注意金属及化合物性质的应用,题目难度中等.

 小学教材完全解读系列答案
小学教材完全解读系列答案| A. | 标准状况下,22.4L 水中所含原子总数为3NA | |
| B. | 1molNa2O2与足量CO2反应转移的电子数2NA | |
| C. | 标准状况下,44.8 L NO与22.4 LO2混合后气体中分子总数为3NA | |
| D. | 1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA |
| A. | 蛋白质和氨基酸 | B. | 淀粉和纤维素 | ||
| C. | 葡萄糖和果糖 | D. | 植物油和动物脂肪 |
| 选项 | 操作 | 现象 | 解释或结论 |
| A | 用容量瓶配制溶液时,定容后摇匀 | 液面低于刻度线 | 浓度一定偏高 |
| B | 燃着的镁条深入盛CO2的集气瓶中 | 镁条继续燃烧 | 镁有比较强的还原性 |
| C | 分别向酸性KMnO4溶液中加入FeCl2或通入SO2 | 酸性KMnO4溶液颜色均褪去 | Fe2+具有还原性,SO2具有漂白性 |
| D | 过量Fe粉加入稀HNO3中,充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化Fe3+ |
| A. | A | B. | B | C. | C | D. | D |

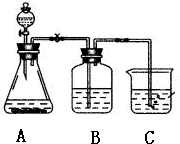
| A. | 用图1所示装置从KI和I2的固体混合物中回收I2 | |
| B. | 用图2所示装置配制100mL0.10mol•L-1 K2Cr2O7溶液 | |
| C. | 用图3所示装置干燥少量的SO2的气体 | |
| D. | 用图4所示装置蒸干FeCl3饱和溶液制备FeCl3晶体 |
| A. | NH3+H3O+═NH${\;}_{4}^{+}$+H2O:NH3结合H+的能力比H2O强 | |
| B. | Al2O3+2NaOH═2NaAlO2+H2O:Al2O3是两性氧化物 | |
| C. | HClO+SO2+H2O═HCl+H2SO4:酸性 HClO>H2SO4 | |
| D. | 已知C(s,石墨)=C(s,金刚石)△H=+1.9 kJ/mol:金刚石比石墨稳定 |
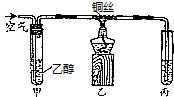
 某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验:
某学习小组同学为了确定盐酸、苯酚、碳酸的酸性强弱,设计了如图所示的装置图进行实验: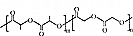 )制成的外科手术缝线在人体内可降解,省去了缝合皮肤后拆线的麻烦,合成PLGA的一种路线如图:
)制成的外科手术缝线在人体内可降解,省去了缝合皮肤后拆线的麻烦,合成PLGA的一种路线如图: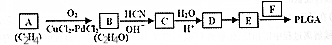
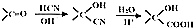
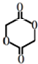 ;
;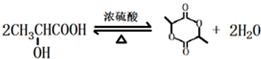 ;
;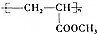 的合成线路:
的合成线路: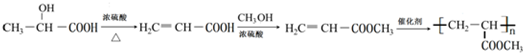 .
.