题目内容
9.已知:2NO2(g)?N2O4(g)△H<0有容积相同的密闭容器甲和乙,甲加入0.1mol N2O4,乙加入0.2mol N2O4,相同温度下分别达到平衡.下例说法正确的是( )| A. | 甲、乙化学平衡移动方向不同 | B. | 甲、乙平衡是NO2的体积分数相同 | ||
| C. | 甲、乙平衡是N2O4的体积分数甲<乙 | D. | 甲、乙升温时,υ(逆)增大、υ(正)减小 |
分析 A、四氧化二氮都转化为二氧化氮;
B、乙加入0.2mol N2O4,相当将两个甲压缩在一个容积中;
C、增大压强平衡正向移动;
D、甲、乙升温时,正逆反应速率都增大.
解答 解:A、四氧化二氮都转化为二氧化氮,所以方向相同,故A错误;
B、乙加入0.2mol N2O4,相当将两个甲压缩在一个容积中,所以乙相当在甲的基础上增压,平衡正向移动,二氧化氮的体积分数减少,故B错误;
C、增大压强平衡正向移动,所以N2O4的体积分数甲<乙,故C正确;
D、甲、乙升温时,正逆反应速率都增大,故D错误;
故选C.
点评 本题考查较为综合,题目难度中等,注意把握化学反应速率以及化学平衡的基本知识即可解答该题.

练习册系列答案
相关题目
20.在溶液中能大量共存的离子组是( )
| A. | Na+、Cl-、NO3- | B. | Ca2+、Cl-、CO32- | C. | K+、H+、HCO3- | D. | Cu2+、H+、OH- |
4.固体粉末X中可能含有K2SO3、KAlO2、MgCl2、Na2CO3中的一种或几种.为确定该固体粉末的成分,现取X进行下列实验,实验过程及现象如图:
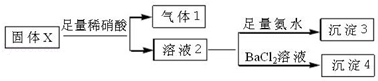
根据上述实验,以下说法正确的是( )

根据上述实验,以下说法正确的是( )
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3和KAlO2 |
14.物质的量浓度相等的三种溶液:①H2C03②NaOH③Na2C03溶液,下列说法不正确的是( )
| A. | 水电离出的c(OH):③>①>② | |
| B. | 溶液的pH:②>③>① | |
| C. | ①和②等体积混合后的溶液:c(Na+)═c(H2C03)+c(HC03)+c(C032-) | |
| D. | ①和③等体积混合后的溶液:c(Na+)>c(HC03-)>c(C032-)>c(OH-)>c(H+) |
18.将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一.已知:
TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ?mol-1
C(s,石墨)+O2(g)═CO2(g)△H=-110.5kJ?mol-1
则反应TiO2(s)+2Cl2(g)+C(s,石墨)═TiCl4(l)+CO2(g)的△H是( )
TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ?mol-1
C(s,石墨)+O2(g)═CO2(g)△H=-110.5kJ?mol-1
则反应TiO2(s)+2Cl2(g)+C(s,石墨)═TiCl4(l)+CO2(g)的△H是( )
| A. | +30.0kJ?mol-1 | B. | -80.5kJ?mol-1 | C. | -30.0kJ?mol-1 | D. | +80.5kJ?mol-1 |

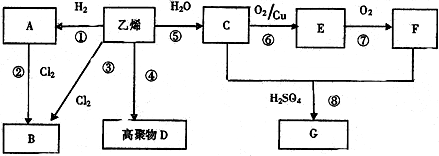
 ,F中所含官能团的名称是羧基;A的二溴代物的结构有2种.
,F中所含官能团的名称是羧基;A的二溴代物的结构有2种.