题目内容
19.中学常见物质A~L的转化关系如下图:(无关产物已略去)①A、B、H均为单质,A、B有金属光泽,A可以在常温下溶于L的浓溶液,H为黄色固体,向由A、B粉未组成的均匀混合物中加入无色纯液体C(少量)后,产生大量紫色蒸气.
②D、E、F、I、L都是无色溶液,G是无色气体.

③K是一种白色沉淀,J是一种黄色沉淀,将G通入E后可以产生一种黑色沉淀和L.
(1)写出下列物质的名称:B碘 H硫
(2)写出试题中出现的几种沉淀的化学式:黄色沉淀AgI;黑色沉淀Ag2S.
(3)写出B和G反应的离子方程式I2+H2S=S↓+2H++2I-.
(4)写出电解E溶液的电极反应式:阳极:4OH--4e-=2H2O+O2↑;阴极:Ag++e-=4Ag.
分析 “向由A、B粉未组成的均匀混合物中加入无色纯液体C(少量)后,产生大量紫色蒸气”可知Zn 与I2 在H2 O为催化剂下反应生成ZnI2 (D),又因H为黄色固体单质,可知H为S,再结合题设条件和框图转化可推知G为H2 S,F为HI溶液,E为AgNO3 溶液,I为Zn(NO3 )2 溶液、J为AgI沉淀、L为HNO3 溶液、K为Zn(OH)2,B和G生成F和H,则B为碘,所以A为锌,电解AgNO3 溶液时,Ag+ 在阴极获得电子产生Ag:4Ag++4e-=4Ag,OH- 在阳极失去电子产生O2:4OH--4e-=2H2 O+O2↑,据此答题.
解答 解:O为催化剂下反应生成ZnI2 (D),又因H为黄色固体单质,可知H为S,再结合题设条件和框图转化可推知G为H2 S,F为HI溶液,E为AgNO3 溶液,I为Zn(NO3 )2 溶液、J为AgI沉淀、L为HNO3 溶液、K为Zn(OH)2,B和G生成F和H,则B为碘,所以A为锌,
(1)根据上面的分析可知,B为碘,H为硫,
故答案为:碘;硫;
(2)根据上面的分析可知,黄色沉淀J 的化学式为AgI,黑色沉淀的化学式为Ag2S,
故答案为:AgI;Ag2S;
(3)B和G反应的离子方程式为I2+H2S=S↓+2H++2I-,
故答案为:I2+H2S=S↓+2H++2I-;
(4)电解AgNO3 溶液时,Ag+ 在阴极获得电子产生Ag:4Ag++4e-=4Ag,OH- 在阳极失去电子产生O2:4OH--4e-=2H2 O+O2↑,
故答案为:4OH--4e-=2H2O+O2↑;Ag++e-=4Ag.
点评 本题主要考查了常见物质的推断与性质,根据A、B在水的条件下反应的现象进行推断是解题的关键,题目难度中等.

练习册系列答案
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
9.空气中SO2含量是重要的空气质量指标.
ⅰ、某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10-3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
(1)取25.00ml的烟道气的水溶液所用仪器名称是酸式滴定管
(2)滴定终点标志为滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色
(3)该厂排放的烟道气中SO2的含量为0.512mg/(L烟道气)
ⅱ、该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
(1)该白色浑浊物为BaSO4,产生该现象的原因可能是空气和溶液中氧气把H2SO3氧化成了H2SO4,从而生成BaSO4
(2)为了避免产生沉淀,该同学设计了如下实验装置,
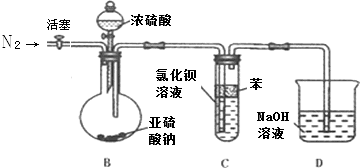
请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2,其作用是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响.
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误错误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4.
ⅰ、某工厂SO2的排放量规定不得超过0.10mg/(L烟道气),为测定该工厂排放的烟道气中SO2的含量,某同学某次抽取了30.00L烟道气缓慢通过1L水,设SO2完全被吸收,设溶液体积为1L,用1.0×10-3mol/L的饱和碘水(密度为1g/cm3)滴定,反应为SO2+I2+2H2O═H2SO4+2HI,实验所记录数据如下:
| 溶有SO2的溶液体积 | 饱和碘水体积 | 指示剂 | |
| 第一次 | 25.00mL | 6.05 | 2~3滴淀粉 |
| 第二次 | 25.00mL | 7.20 | 2~3滴淀粉 |
| 第三次 | 25.00mL | 5.95 | 2~3滴淀粉 |
(2)滴定终点标志为滴入最后一滴试液时,溶液变为蓝色,并半分钟内不褪色
(3)该厂排放的烟道气中SO2的含量为0.512mg/(L烟道气)
ⅱ、该同学在实验室还验证了SO2能否与BaCl2溶液反应的实验.二氧化硫通入氯化钡溶液中理论上不产生沉淀,但当他把SO2通入装有1mol/LBaCl2溶液的试管中后,出现了白色浑浊物.
(1)该白色浑浊物为BaSO4,产生该现象的原因可能是空气和溶液中氧气把H2SO3氧化成了H2SO4,从而生成BaSO4
(2)为了避免产生沉淀,该同学设计了如下实验装置,

请回答下列问题
①反应开始前,先向制取SO2的装置中通入纯净的N2,其作用是:赶出装置中的气体,防止二氧化硫通入氯化钡溶液后的现象受到空气和溶液中氧气的影响.
②该同学认为Ba(NO3)2溶液与BaCl2溶液一样在理论上与SO2也不会反应,请先判断正误错误(填“正确”、“错误”),如不正确则写出SO2与Ba(NO3)2溶液反应的化学方程式Ba(NO3)2+3SO2+2H2O=BaSO4↓+2NO+2H2SO4.
7.欲分离某CCl4和H2O的混合液,除铁架台、铁圈外,还需要用到的仪器是( )
| A. | 漏斗 | B. | 长颈漏斗 | C. | 分液漏斗 | D. | 直形冷凝管 |
11.“类推”的思维方式在化学学习与研究中经常用到,但有时产生错误的结论.下列类推结论正确的是( )
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由Na20中阴阳离子个数比为1:2,可推知Na202中阴阳离子个数比为1:1 | |
| C. | 由铁和溴反应生成溴化铁,可推知铁和碘单质反应生成碘化铁 | |
| D. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 |
8.如图所示是氨催化氧化制备硝酸的实验装量,下有关叙述正确的是( )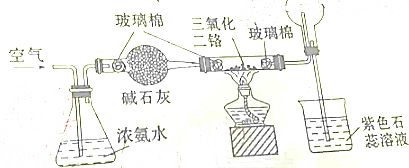

| A. | 烧杯中的紫色石蕊溶液不变色 | |
| B. | 圆底烧瓶中的气体一定为无色 | |
| C. | 加热后,通过三氯化二铬的气体由无色变为红棕色 | |
| D. | 三氯化二铬起氧化剂的作用 |
9.已知:2NO2(g)?N2O4(g)△H<0有容积相同的密闭容器甲和乙,甲加入0.1mol N2O4,乙加入0.2mol N2O4,相同温度下分别达到平衡.下例说法正确的是( )
| A. | 甲、乙化学平衡移动方向不同 | B. | 甲、乙平衡是NO2的体积分数相同 | ||
| C. | 甲、乙平衡是N2O4的体积分数甲<乙 | D. | 甲、乙升温时,υ(逆)增大、υ(正)减小 |