题目内容
20.在溶液中能大量共存的离子组是( )| A. | Na+、Cl-、NO3- | B. | Ca2+、Cl-、CO32- | C. | K+、H+、HCO3- | D. | Cu2+、H+、OH- |
分析 根据离子之间不能结合生成沉淀、气体、水等,则离子大量共存,以此来解答.
解答 解:A.该组离子之间不反应,可大量共存,故A正确;
B.Ca2+、CO32-结合生成沉淀,不能大量共存,故B错误;
C.H+、HCO3-结合生成水和气体,不能大量共存,故C错误;
D.Cu2+、H+分别与OH-结合生成沉淀、水,不能大量共存,故D错误;
故选A.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
相关题目
11.“类推”的思维方式在化学学习与研究中经常用到,但有时产生错误的结论.下列类推结论正确的是( )
| A. | 由氢氟酸刻蚀玻璃可推知盐酸也能用来刻蚀玻璃 | |
| B. | 由Na20中阴阳离子个数比为1:2,可推知Na202中阴阳离子个数比为1:1 | |
| C. | 由铁和溴反应生成溴化铁,可推知铁和碘单质反应生成碘化铁 | |
| D. | 由钠与冷水剧烈反应,可推知钾也能与冷水剧烈反应 |
8.如图所示是氨催化氧化制备硝酸的实验装量,下有关叙述正确的是( )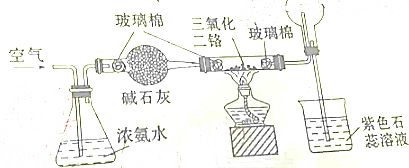

| A. | 烧杯中的紫色石蕊溶液不变色 | |
| B. | 圆底烧瓶中的气体一定为无色 | |
| C. | 加热后,通过三氯化二铬的气体由无色变为红棕色 | |
| D. | 三氯化二铬起氧化剂的作用 |
5.现有失去标签的四瓶无色溶液分别为Na2CO3溶液、稀盐酸、Ba(OH)2溶液、NaHSO4溶液,为确定四瓶溶液分别是什么,将其随意标号为A、B、C、D,分别取少量溶液两两混合,产生的现象如下表所示.
已知:NaHSO4属于酸式盐,在水溶液中的电离方程式为:NaHSO4═Na++H++SO42-.
根据实验现象,回答下列问题:
(1)A为Na2CO3溶液,C为稀盐酸.
(2)写出下列反应的离子方程式
A+BCO32-+Ba2+=BaCO3↓,A+DCO32-+2H+=CO2↑+H2O,
(3)等物质的量浓度、等体积的B、D混合反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,反应后得到的溶液中含有的阴离子有OH-.
(4)上述没有明显变化的实验④、⑥,其中④发生了离子反应,离子方程式为H++OH-=H2O.请设计实验证明其发生了反应取少量Ba(OH)2溶液滴入几滴酚酞试液,溶液显红色,向该红色溶液中加入稀盐酸至过量,溶液变为无色,说明酸碱发生反应.(试剂任选)
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 生成白色沉淀 |
| ② | A+C | 放出无色气体 |
| ③ | A+D | 放出无色气体 |
| ④ | B+C | 无明显变化 |
| ⑤ | B+D | 生成白色沉淀 |
| ⑥ | C+D | 无明显变化 |
根据实验现象,回答下列问题:
(1)A为Na2CO3溶液,C为稀盐酸.
(2)写出下列反应的离子方程式
A+BCO32-+Ba2+=BaCO3↓,A+DCO32-+2H+=CO2↑+H2O,
(3)等物质的量浓度、等体积的B、D混合反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,反应后得到的溶液中含有的阴离子有OH-.
(4)上述没有明显变化的实验④、⑥,其中④发生了离子反应,离子方程式为H++OH-=H2O.请设计实验证明其发生了反应取少量Ba(OH)2溶液滴入几滴酚酞试液,溶液显红色,向该红色溶液中加入稀盐酸至过量,溶液变为无色,说明酸碱发生反应.(试剂任选)
12.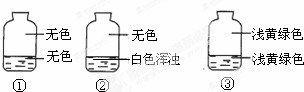 向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察如图所记录的现象,判断各瓶注入的液体依次是什么.( )
向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察如图所记录的现象,判断各瓶注入的液体依次是什么.( )
 向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察如图所记录的现象,判断各瓶注入的液体依次是什么.( )
向盛有氯气的三个集气瓶中,分别注入约五分之一的下列液体并振荡,观察如图所记录的现象,判断各瓶注入的液体依次是什么.( )| A. | AgNO3溶液、NaOH溶液、水 | B. | NaOH溶液、AgNO3溶液、水 | ||
| C. | 水、AgNO3溶液、NaOH溶液 | D. | AgNO3溶液、水、NaOH溶液 |
9.已知:2NO2(g)?N2O4(g)△H<0有容积相同的密闭容器甲和乙,甲加入0.1mol N2O4,乙加入0.2mol N2O4,相同温度下分别达到平衡.下例说法正确的是( )
| A. | 甲、乙化学平衡移动方向不同 | B. | 甲、乙平衡是NO2的体积分数相同 | ||
| C. | 甲、乙平衡是N2O4的体积分数甲<乙 | D. | 甲、乙升温时,υ(逆)增大、υ(正)减小 |
10.下列设计的实验方案能达到实验目的是( )
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
