题目内容
18.将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一.已知:TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ?mol-1
C(s,石墨)+O2(g)═CO2(g)△H=-110.5kJ?mol-1
则反应TiO2(s)+2Cl2(g)+C(s,石墨)═TiCl4(l)+CO2(g)的△H是( )
| A. | +30.0kJ?mol-1 | B. | -80.5kJ?mol-1 | C. | -30.0kJ?mol-1 | D. | +80.5kJ?mol-1 |
分析 根据盖斯定律,由已知热化学方程式①+②可构造出目标热化学方程式,注意反应热也处于相应的系数进行相应的加减,据此进行解答.
解答 解:已知:①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)△H=+140.5kJ/mol
②C(s,石墨)+O2(g)═CO2(g)△H=-110.5kJ?mol-1,
根据盖斯定律①+②可得:TiO2(s)+2Cl2(g)+C(s,石墨)═TiCl4(l)+CO2(g)△H=+140.5kJ/mol+(-110.5kJ/mol)=+30.0kJ/mol,
故选A.
点评 本题考查盖斯定律、反应热的计算,题目难度中等,理解盖斯定律并利用已知热化学方程式进行叠加构造目标热化学方程式是关键,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
8.如图所示是氨催化氧化制备硝酸的实验装量,下有关叙述正确的是( )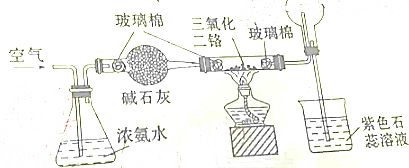

| A. | 烧杯中的紫色石蕊溶液不变色 | |
| B. | 圆底烧瓶中的气体一定为无色 | |
| C. | 加热后,通过三氯化二铬的气体由无色变为红棕色 | |
| D. | 三氯化二铬起氧化剂的作用 |
9.已知:2NO2(g)?N2O4(g)△H<0有容积相同的密闭容器甲和乙,甲加入0.1mol N2O4,乙加入0.2mol N2O4,相同温度下分别达到平衡.下例说法正确的是( )
| A. | 甲、乙化学平衡移动方向不同 | B. | 甲、乙平衡是NO2的体积分数相同 | ||
| C. | 甲、乙平衡是N2O4的体积分数甲<乙 | D. | 甲、乙升温时,υ(逆)增大、υ(正)减小 |
6.一种固态烃的分子式为C12H12,经测定分子中无环状结构,由此推测该烃分子中最多含有碳碳双键的数目为( )
| A. | 6 | B. | 7 | C. | 10 | D. | 14 |
10.下列设计的实验方案能达到实验目的是( )
| A. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 |
7.下列关于现在的长式元素周期表的说法中正确的是( )
| A. | 从左向右数第六纵行是ⅥA族 | B. | 七个周期18个族 | ||
| C. | ⅠA族全部是金属元素 | D. | 所含元素种类最多的族是ⅢB族 |
8.用下列实验仪器或装置进行相应实验,能达到实验目的是( )
| A. |  实验测定氯水的pH | |
| B. | 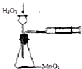 实验定量测定H2O2的分解速率 | |
| C. | 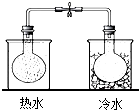 实验中利用NO2颜色的变化验证其中反应的热效应 | |
| D. | 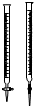 实验中(乙)管内盛放已知浓度的KMnO4溶液来测定FeSO4溶液的浓度 |
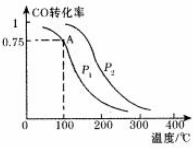 CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.
CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法.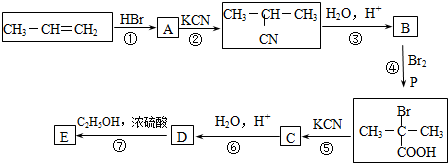

 .
.