题目内容
2.对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表为几种弱酸在25℃时的电离平衡常数| 酸 | 电离平衡常数K |
| CH3COOH | 1.76×10-5 |
| H2CO3 | K1=4.3×10-7 K2=5.61×10-11 |
| H3PO4 | K1=7.52×10-3 K2=6.23×10-8 K3=2.20×10-13 |
(1)从电离的角度,HCO3-、HPO42-、H2PO4-都可看作是酸,其中酸性最强的是H2PO4-,最弱的是HPO42-.
(2)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,c mol/L的CH3COOH的电离转化率为a,则该温度下醋酸的电离平衡常数KCH3COOH=$\frac{c{a}^{2}}{1-a}$.
分析 (1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数确定酸性强弱;
(2)溶液中c(CH3COO-)=c(H+)=camo/L,根据电离平衡常数KCH3COOH=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$进行计算即可.
解答 解:(1)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,酸性最强的是H2PO4-,最弱的是HPO42-,
故答案为:H2PO4-;HPO42-;
(2)25℃时,c mol/L的CH3COOH的电离转化率为a,溶液中c(CH3COO-)=c(H+)=camo/L,
则该温度下醋酸的电离平衡常数为:KCH3COOH=$\frac{c({H}^{+})•c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=$\frac{ca×ca}{c-ca}$=$\frac{c{a}^{2}}{1-a}$,
故答案为:$\frac{c{a}^{2}}{1-a}$.
点评 本题考查了弱电解质的电离及其影响,题目难度中等,明确酸的电离平衡常数与酸性强弱的关系是解本题关键,注意掌握电离平衡常数的概念及表达式,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
14.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2LH2O所含分子数为0.5NA | |
| B. | 1mol•L-1CaCl2溶液中所含Ca2+离子的数目为NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 0.1molZn与含0.1molHCl的盐酸溶液充分反应,转移电子数目为0.2NA |
15.已知含Cr(Ⅵ)的盐溶液存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O,改变溶液中CrO42-、Cr2O72-的离子浓度比,可使溶液颜色发生变化.现向显黄色的试液中加入哪种物质,能使溶液变为橙色( )
| A. | H2O | B. | 硫酸 | C. | NaOH(s) | D. | Na2SO4(s) |
11.下列关于电解池的说法正确的是( )
| A. | 电源的负极就是阴极 | |
| B. | 与直流电源正极相连的是电解池的阴极 | |
| C. | 与直流电源负极相连的电极上发生还原反应 | |
| D. | 阳极上发生还原反应 |
 反应A,可实现氯的循环利用。
反应A,可实现氯的循环利用。 4mol HCl被氧化,放出115.6kJ的热量。
4mol HCl被氧化,放出115.6kJ的热量。
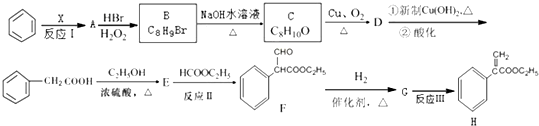
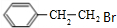 ;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基.
;E的分子式为C10H12O2;F中含氧官能团的名称是醛基、酯基. .
.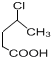 制备
制备 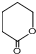 的合成路线流程
的合成路线流程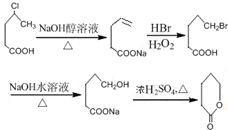 .
.