题目内容
6.可逆反应:2A(g)?3B(?)+C(?)(正反应是吸热反应),随着温度升高,气体平均相对分子质量有减小趋势,下列判断正确的是( )| A. | B和C可能都是固体 | B. | B和C一定都是气体 | ||
| C. | 若C为固体,则B一定是气体 | D. | B是固体和C是气体 |
分析 正反应吸热,随着温度的升高,则平衡向正反应方向移动,气体平均相对分子质量变小,如气体的质量不变,则说明气体的物质的量增多,如气体的质量减小,则气体的物质的量不变也符合,以此解答该题.
解答 解:A.如B、C都是固体,则气体的平均相对分子质量不变,因为气体只有A,故A错误;
B.如B为气体,C为固体或液体,则升高温度平衡向正反应方向移动,气体的总质量减小,但物质的量不变,则气体平均相对分子质量变小,故B错误;
C.若C为固体,则B一定是气体,否则气体的平均相对分子质量不变,故C正确;
D.如B是固体和C为气体,平衡向正反应方向移动,气体的质量减小,气体的物质的量减小,则气体平均相对分子质量不一定减小,故D错误;
故选C.
点评 本题考查化学平衡移动,题目难度中等,注意判断气体的平均相对分子质量减小的两种情况.

练习册系列答案
相关题目
17.表示下列反应的离子方程式正确的是( )
| A. | 金属钠加入到CuSO4溶液中:2Na+Cu2+═Cu+2Na+ | |
| B. | 铁粉加入到FeCl3溶液中:Fe+2Fe3+═3Fe2+ | |
| C. | 金属铝加入到NaOH溶液中:Al+2OH-+H2O═AlO2-+2H2↑ | |
| D. | 铜片插入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
14.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2LH2O所含分子数为0.5NA | |
| B. | 1mol•L-1CaCl2溶液中所含Ca2+离子的数目为NA | |
| C. | 通常状况下,32gO2与32gO3所含的氧原子数均为2NA | |
| D. | 0.1molZn与含0.1molHCl的盐酸溶液充分反应,转移电子数目为0.2NA |
1.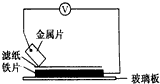 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
已知构成原电池两电极的金属活动性相差越大,电压表读数越大.请根据以上实验记录完成下列填空:
(1)金属C(填字母)可能是最强还原剂.
(2)若滤纸用稀硝酸溶液浸润,一段时间后在滤纸上能看到蓝色,则金属片为B(填字母),其对应的原电池正极的电极反应式为Cu-2e-=Cu2+.
(3)利用A和B两种金属相互置换反应可以设计出一种二次电池,其总反应可表示为:2B+AO$?_{②}^{①}$B2O+A
这个电池充电过程的反应为①(填①或②),得到这个结论的理由是金属性A>B,②为自发进行的氧化还原反应.
 将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D
将洁净的金属片A、B、C、D分别放置在浸有盐溶液的滤纸上面并压紧(如图所示).在每次实验时,记录电压指针的移动方向和电压表的读数如下表如示说法正确的是D| A.在四种金属中C的还原性最弱 |
| B.金属B能从硫酸铜溶液中置换出铜 |
| C.AD若形成原电池时A为正极 |
| D.AB形成合金时,将该合金露置在空气中,A先被腐蚀 |
| 金属 | 电子流动方向 | 电压/V |
| A | A→Cu | +0.78 |
| B | Cu→B | +0.15 |
| C | C→Cu | +1.35 |
| D | D→Cu | +0.30 |
(1)金属C(填字母)可能是最强还原剂.
(2)若滤纸用稀硝酸溶液浸润,一段时间后在滤纸上能看到蓝色,则金属片为B(填字母),其对应的原电池正极的电极反应式为Cu-2e-=Cu2+.
(3)利用A和B两种金属相互置换反应可以设计出一种二次电池,其总反应可表示为:2B+AO$?_{②}^{①}$B2O+A
这个电池充电过程的反应为①(填①或②),得到这个结论的理由是金属性A>B,②为自发进行的氧化还原反应.
11.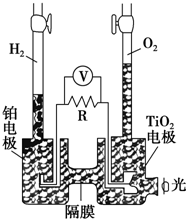 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
 TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )
TiO2在光照射下可使水分解:2H2O$\frac{\underline{\;TiO_{2}\;}}{光}$2H2↑+O2↑,该过程类似植物的光合作用.如图是光照射下TiO2分解水的装置示意图,电解质溶液为稀硫酸.下列叙述正确的是( )| A. | 该装置只能将光能转化为电能 | |
| B. | TiO2电极上发生的反应为:2H++2e-═H2↑ | |
| C. | 该装置工作时,电流由TiO2电极经R流向铂电极 | |
| D. | 该装置工作时,TiO2电极附近溶液的pH变小 |
15.已知含Cr(Ⅵ)的盐溶液存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O,改变溶液中CrO42-、Cr2O72-的离子浓度比,可使溶液颜色发生变化.现向显黄色的试液中加入哪种物质,能使溶液变为橙色( )
| A. | H2O | B. | 硫酸 | C. | NaOH(s) | D. | Na2SO4(s) |
 氯碱工业中电解饱和食盐水的原理示意图如图所示:
氯碱工业中电解饱和食盐水的原理示意图如图所示: