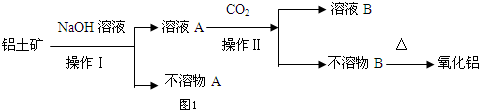
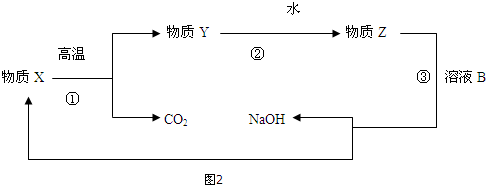
题目内容
5.在298K、1.01×105Pa下,将22g CO2通入750mL 1mol•L-1 NaOH的溶液中充分反应,测得反应放出x kJ的热量.已知在该条件下,1mol CO2通入1L 2mol•L-1 NaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )| A. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2y-x)kJ•mol-1 | |
| B. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(4x-y)kJ•mol-1 | |
| C. | CO2(g)+NaOH(aq)═NaHCO3(aq)△H=-(2x-y)kJ•mol-1 | |
| D. | 2CO2(g)+2NaOH(l)═2NaHCO3(l)△H=-(8x-2y)kJ•mol-1 |
分析 根据题意可知,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1mol CO2通入2mol•L-1NaOH溶液1L中充分反应放出y kJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式.
解答 解:根据题意,22gCO2通入1mol•L-1NaOH溶液750mL中充分反应,n(CO2)=$\frac{22g}{44g/mol}$=0.5mol,n(NaOH)=1mol•L-1×0.75L=0.75mol,
该反应既生成碳酸钠又生成碳酸氢钠,方程式为2CO2+3NaOH═NaHCO3+Na2CO3+H2O,
由0.5molCO2反应放出热量为xKJ,则2molCO2反应放出热量为4xKJ,即热化学反应方程式为
2CO2(g)+3NaOH(aq)═NaHCO3 (aq)+Na2CO3(aq)+H2O(l)△H=-4xKJ/mol①,
又1mol CO2通入2mol•L-1NaOH溶液1L中充分反应放出y kJ的热量,则热化学方程式为
2NaOH(aq)+CO2(g)═Na2CO3(aq)+H2O(l)△H=-yKJ/mol②,
由盖斯定律可知,①-②可得,NaOH(aq)+CO2(g)═NaHCO3(aq)△H=-(4x-y)KJ/mol,
故选B.
点评 本题考查热化学方程式的书写和计算,是高考中常见题型,计算中涉及到化学方程式的有关计算问题和盖斯定律的有关应用,是一重点题型,学生还应注意在书写热化学方程式时标明各物质的状态.

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
15.下列装置所示的实验中,能达到实验目的是( )
| A. |  分离碘酒中 的碘和酒精 | B. |  实验室制氧气 | ||
| C. |  除去Cl2中的HCl | D. |  排水集气法收集NO |
20.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 常温常压下,28 g N2所含电子数为10NA | |
| B. | 46 g钠充分燃烧时转移电子数为2NA | |
| C. | 0.1 mol•L-1NH4Cl溶液中Cl-离子数为0.1NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
10.下列有关化学用语正确的是( )
| A. | 26Fe的价层电子排布式为3d64s2 | |
| B. | 35Br的电子排布式可简写为[Ar]4s24p5 | |
| C. | NH4Cl的电子式为 | |
| D. | 某基态原子核外电子排布图为: |
17.下列叙述正确的是( )
| A. | 分子式为C3H6有机物最多存在3个C-C单键,与C4H10的碳碳单键数相同 | |
| B. | 乙烯、聚氯乙烯和苯分子中均含有碳碳双健 | |
| C. | 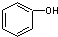 和 C7H8O分子组成相差一个-CH2-,因此是同系物关系 和 C7H8O分子组成相差一个-CH2-,因此是同系物关系 | |
| D. | 分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可以确定有机物结构简式为C2H5-OH |
14. 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.
(1)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
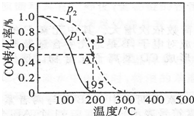
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如下图所示,P2及195℃时n(H2)随时间的变化如表所示:
①O~3min,平均速率V(CH3OH)=O.033mo1•L-1•min-1,Q<0(填“<”“=”或“>”).
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,增大压强CO转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
 甲醇是重要的化工原料,在化工生产中有广泛的应用.
甲醇是重要的化工原料,在化工生产中有广泛的应用.(1)已知反应:CO(g)+2H2(g)?CH3OH(g)△H=Q
在20L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如下图所示,P2及195℃时n(H2)随时间的变化如表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8 | 5 | 4 | 4 |
②图中压强(P1、P2)的大小顺序为P1<P2,理由是相同温度下,增大压强CO转化率提高.
③在P2及195℃时,该反应的平衡常数K=25.
8.下列化学用语正确的是( )
| A. | 氯化钠的电子式 | B. | 氢气的结构式H=H | ||
| C. | 磷原子的结构示意图 | D. | 乙酸的分子式C2H4O2 |