题目内容
11.现有下列短周期元素性质的数据:| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)上述元素中处于VA族的有:④⑦(用编号表示)
(2)处于第2周期的元素有:①③⑦⑧被称为“矾”的一类化合物中肯定含有表中①(以上均用编号表示)
(3)写出②、⑤的元素符号:Mg、Cl.
(4)上述元素中金属性最强的是:Na(用元素符号表示)
分析 ①只有最低价-2价,则①为O;⑤有+7、-1价,处于ⅦA族,为Cl元素;④⑦有+5、-3价,处于ⅤA族,且④原子半径较大,则④为P、⑦为N;③⑥只有最高正价+1价,处于ⅠA族,且⑥的原子半径较大,③原子半径不是最小,则③为Li、⑥为Na;②最高价+2价,处于ⅡA族,原子半径大于P,则②为Mg;⑧最高价为+3价,处于ⅢA族,原子半径小于P元素,则⑧为B元素,⑤有+7、-1价,为Cl元素,然后结合元素化合物知识解答.
解答 解:①只有最低价-2价,则①为O;⑤有+7、-1价,处于ⅦA族,为Cl元素;④⑦有+5、-3价,处于ⅤA族,且④原子半径较大,则④为P、⑦为N;③⑥只有最高正价+1价,处于ⅠA族,且⑥的原子半径较大,③原子半径不是最小,则③为Li、⑥为Na;②最高价+2价,处于ⅡA族,原子半径大于P,则②为Mg;⑧最高价为+3价,处于ⅢA族,原子半径小于P元素,则⑧为B元素,⑤有+7、-1价,为Cl元素,
(1)上述元素中处于VA族的有④⑦,故答案为:④⑦;
(2)处于第2周期的元素有①③⑦⑧,被称为“矾”的一类化合物(含O、H、S元素)中肯定含有表中①,故答案为:①③⑦⑧;①;
(3)②、⑤的元素符号分别为Mg、Cl,故答案为:Mg;Cl;
(4)上述元素中金属性最强的是Na,故答案为:Na.
点评 本题考查原子结构与元素周期律,为高频考点,把握元素的半径、化合价推断元素为解答的关键,侧重分析与应用能力的考查,注意元素周期律的应用,题目难度不大.

练习册系列答案
相关题目
1.现有部分短周期元素的性质或原子结构如下表:
(1)元素X的一种同位素可测定文物年代,这种同位素的中子数是8.
(2)元素Y与R形成一种离子YR${\;}_{4}^{+}$,写出该微粒的电子式: (用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应.
| 元素编号 | 元素性质或原子结构 |
| R | 原子半径最小的元素 |
| T | M层上有6个电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
(2)元素Y与R形成一种离子YR${\;}_{4}^{+}$,写出该微粒的电子式:
 (用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑
(用元素符号表示).它们还可以形成分子YR3,写出实验室制取该物质的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑(3)元素Z与元素T相比,非金属性较强的是Cl(用元素符号表示),下列表述中能证明这一事实的是②.
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应.
2.下列说法正确的是( )
| A. | 乙酸与NaHCO3反应生成CO2气体,说明乙酸的酸性强于碳酸 | |
| B. | 乙烯使溴水褪色的反应方程式是:CH2=CH2+Br2→CH3CHBr2 | |
| C. | 乙烯和苯分子中都存在碳碳双键,都能发生加成反应 | |
| D. | 乙醇能发生氧化反应,乙酸不能发生氧化反应 |
2.在一定条件下,$RO_3^{n-}$和I-发生反应的离子方程式为:$RO_3^{n-}$+6I-+6H+=R-+3I2+3H2O(R为主族元素)则:R元素最外层电子数为( )
| A. | 7 | B. | 5 | C. | 3 | D. | 4 |
6.关于晶体的下列说法正确的是( )
| A. | 晶体中的化学键都具有饱和性和方向性 | |
| B. | 晶体中只要有阴离子,就一定有阳离子 | |
| C. | 石墨是一种典型的原子晶体 | |
| D. | 冰中存在极性共价键和氢键两种化学键 |
 ,C原子的结构示意图为
,C原子的结构示意图为 .
.
 )(F1和F2互为同分异构体)(G1和G2互为同分异构体)
)(F1和F2互为同分异构体)(G1和G2互为同分异构体) .
.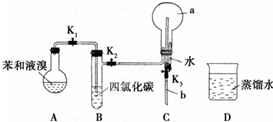
 ,烧瓶a中的实验现象是烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉.
,烧瓶a中的实验现象是烧杯中的水沿玻璃管上升进入烧瓶,形成喷泉.