题目内容
17. 常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )
常温下,向100ml0.01mol/LHA溶液中逐滴加入0.02mol/LMOH溶液,如图中所示曲线表示混合溶液的pH变化情况.下列说法中正确的是( )| A. | HA为一元弱酸,MOH为一元强碱 | |
| B. | 滴入MOH溶液的体积为50ml时,(M+)>(A-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | K点时,则有c(MOH)+(M+)=0.02mol/L |
分析 0.01mol•L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,酸或碱性溶液抑制水电离,含有弱根离子的盐促进水电离,根据物料守恒计算K点c(MOH)和c(M+)的和.
解答 解:A.0.01mol•L-1 HA溶液中pH=2,则HA是强酸,N点时溶液呈中性,MOH的物质的量大于HA的物质的量,说明MOH是弱碱,故错误;
B.l00mL 0.01mol/L HA的溶液中逐滴加入0.02mol/L MOH溶液50ml,反应后溶液中是MA溶液,c(A-)>c(M+),故错误;
C.N点溶液呈中性,K点溶液呈碱性,碱性溶液抑制水电离,所以N点水的电离程度大于K点水的电离程度,故正确;
D.在K点时混合溶液体积是碱溶液的2倍,根据物料守恒结合溶液体积变化知,c(MOH)和c(M+)的和是原来MOH浓度的一半,故错误;
故选C.
点评 本题考查了酸碱反应的定量分析判断,掌握弱电解质电离平衡是解题关键,题目难度中等.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
7.25℃时,下列溶液中粒子的物质的量浓度关系正确的是( )
| A. | 向浓度为0.1mol•L-1的NaHCO3溶液中滴加少量盐酸后所得溶液中:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合所得溶液中:c(CH3COO-)+c(H+)>c(Na+)+c(OH-) | |
| C. | 0.1 mol•L-1CH3COOH溶液和0.1 mol•L-1CH3COONa溶液等体积混合:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 0.1 mol•L-1 NH4HSO4溶液中滴加0.1 mol•L-1 NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
12. 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a,b为石墨电极).下列说法中正确的是( )| A. | 电池工作时,正极反应式为O2+2H2O+4e-═4OH- | |
| B. | 电解时,电子流动路径是:负极-→外电路-→阴极-→溶液-→阳极-→正极 | |
| C. | 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时前者的还原性强于后者 | |
| D. | 当电池中消耗0.02g H2时,a极周围会产生0.02gH2 |
2.下列有关环境问题的做法错误的是( )
| A. | 生活污水使用明矾杀菌消毒 | B. | 向燃煤中加入适量石灰石“固硫” | ||
| C. | 推广使用可降解塑料防止白色污染 | D. | 提倡公交出行可减少氮氧化物排放 |
9.根据下列实验操作和现象所得到的结论正确的是( )
| A. | 向NaAlO2溶液中通入足量CO2,有白色沉淀产生,说明碳酸的酸性强于氢氧化铝 | |
| B. | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,说明溶液中不含有K+ | |
| C. | 在KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去,说明SO2具有漂白性 | |
| D. | 向某FeCl2溶液中,加入Na2O2粉末出现红褐色沉淀,说明原FeCl2已氧化变质 |
6.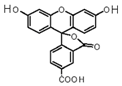 2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )
 2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )
2008年诺贝尔化学奖授予美籍华裔钱永健等三位科学家,以表彰他们发现和研究了绿色荧光蛋白.荧光素是发光物质的基质,5-羧基荧光素(5-FAM)结构简式如图所示,在碱性条件下有强烈的绿色荧光,广泛应用于荧光分析等.下列有关5-FAM说法不正确的是( )| A. | 可与碳酸氢钠溶液反应 | |
| B. | 分子式为C21H12O7 | |
| C. | 1mol 该物质与足量NaOH溶液反应,可消耗4 mol氢氧化钠 | |
| D. | 不与FeCl3发生反应 |

 已知:
已知: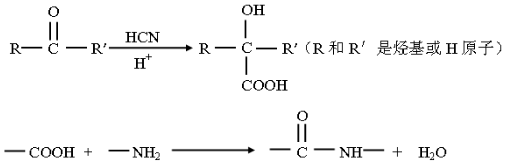
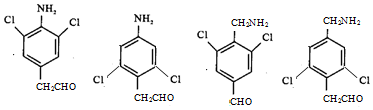
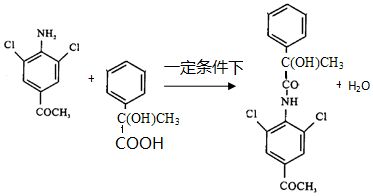
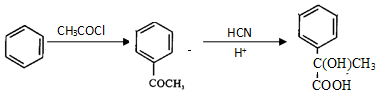 .
.