题目内容
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D、1 mol甲基中电子数为10NA |
考点:阿伏加德罗常数
专题:
分析:A.氯气不足,转移电子数应依据氯气的量计算;
B.铜与稀硫酸不反应;
C.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
D.甲烷去掉一个氢原子剩余部分为甲基.
B.铜与稀硫酸不反应;
C.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
D.甲烷去掉一个氢原子剩余部分为甲基.
解答:
解:A.5.6g铁粉物质的量为0.1mol,在0.1mol氯气中充分燃烧,氯气全部反应转移电子数为0.2NA,故A错误;
B.12.5mL 16mol?L-1浓硫酸中含有0.2mol硫酸,与足量铜如果能够完全反应生成0.1mol二氧化硫,转移了0.2mol电子,但是随着反应的进行浓硫酸的浓度减小,由于铜与稀硫酸不反应,转移的电子的物质的量小于0.2mol,故B错误;
C.7.8g Na2S和Na2O2的物质的量为:
=0.1mol,过氧化钠中阳离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数等于0.1NA,故C正确;
D.一个甲基中含有9个电子,1 mol甲基中电子数为9NA,故D错误;
故选:C.
B.12.5mL 16mol?L-1浓硫酸中含有0.2mol硫酸,与足量铜如果能够完全反应生成0.1mol二氧化硫,转移了0.2mol电子,但是随着反应的进行浓硫酸的浓度减小,由于铜与稀硫酸不反应,转移的电子的物质的量小于0.2mol,故B错误;
C.7.8g Na2S和Na2O2的物质的量为:
| 7.8g |
| 78g/mol |
D.一个甲基中含有9个电子,1 mol甲基中电子数为9NA,故D错误;
故选:C.
点评:本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意只有浓硫酸才能与铜发生反应,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列无色溶液中,能大量共存的离子组是( )
| A、Ba2+、Ca2+、C1-、NO3- |
| B、Ca2+、A13+、Fe3+、CO32- |
| C、NH4+、K+、HSO3-、ClO- |
| D、Na+、K+、MnO4-、I- |
有关原电池和电解池的下列说法中不正确的是( )
| A、原电池负极发生氧化反应 |
| B、电解池阳极发生还原反应 |
| C、通电后,电解池中阳离子向阴极移动 |
| D、原电池中电子从负极沿导线流向正极 |
下列物质的水溶液中,其电离方程式正确的是( )
| A、H2SO4=H2++SO42- |
| B、NaHSO4=Na++HSO4- |
| C、Na2CO3=2Na++CO32- |
| D、Ca(OH)2=Ca2++OH- |
下列表示物质结构的化学用语或模型图正确的是( )
| A、二氧化碳的结构式:O-C-O |
| B、H2O2的电子式:H+[:O:O:]2-H+ |
C、甲烷的比例模型: |
D、14C的原子结构示意图: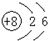 |
下列叙述正确的是( )
| A、1molKOH的摩尔质量为56g |
| B、64gSO2中含有1molO2 |
| C、1molNH3的体积为22.4L |
| D、0.5molCO约含有3.01×1023个CO分子 |
下列生活常见现象中,没有涉及化学变化的是( )
A、 光合作用 |
B、 炭烧取暖 |
C、 风力发电 |
D、 电解冶炼 |