题目内容
下列表示物质结构的化学用语或模型图正确的是( )
| A、二氧化碳的结构式:O-C-O |
| B、H2O2的电子式:H+[:O:O:]2-H+ |
C、甲烷的比例模型: |
D、14C的原子结构示意图: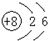 |
考点:球棍模型与比例模型,原子结构示意图,结构式,电子式、化学式或化学符号及名称的综合
专题:
分析:A、二氧化碳分子中存在两个碳氧双键;
B、双氧水为共价化合物,不存在阴阳离子,其电子式不能标出电荷;
C、根据甲烷比例模型的表示方法进行判断;
D、C的核电荷数为6,不是8.
B、双氧水为共价化合物,不存在阴阳离子,其电子式不能标出电荷;
C、根据甲烷比例模型的表示方法进行判断;
D、C的核电荷数为6,不是8.
解答:
解:A、二氧化碳的电子式为: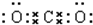 ,所以二氧化碳的结构式为:O=C=O,故A错误;
,所以二氧化碳的结构式为:O=C=O,故A错误;
B、双氧水分子中不存在阴阳离子,故B错误;
C、甲烷是由四个氢原子和1个C原子构成的,C原子半径大于氢原子,且处于正四面体的中心,故C正确;
D、C的核电荷数为6,不是8,故D错误,
故选C.
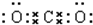 ,所以二氧化碳的结构式为:O=C=O,故A错误;
,所以二氧化碳的结构式为:O=C=O,故A错误;B、双氧水分子中不存在阴阳离子,故B错误;
C、甲烷是由四个氢原子和1个C原子构成的,C原子半径大于氢原子,且处于正四面体的中心,故C正确;
D、C的核电荷数为6,不是8,故D错误,
故选C.
点评:本题考查了电子式、原子结构示意图、球棍模型与比例模型的判断,题目难度中等,注意掌握常见的化学用语的概念及正确表示方法,明确球棍模型与比例模型的表示方法.

练习册系列答案
相关题目
0.8g 某物质含有3.01×1022个分子,该物质的式量约为( )
| A、8 | B、16 | C、64 | D、160 |
用Cl2生产某些含氯有机物时会产生副产物HC1.利用反应A,可实现氯的循环利用.判断下列说法正确的是( )
反应A:4HCl+O2
2Cl2+2H2O
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、
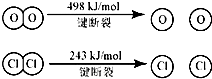
反应A:4HCl+O2
| CuO?CuCl2 |
| 400℃ |
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、

| A、反应A的△H>-115.6kJ/mol |
| B、断开1 mol H-O 键与断开 1 molH-Cl 键所需能量相差约为32kJ |
| C、H2O中H-O 键比HCl中H-Cl键弱 |
| D、由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
下列大小比较正确的是( )
| A、离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl |
| B、稳定性:HF>H2O>NH3>CH4; 还原性:HF<H2O<NH3<CH4 |
| C、碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na |
| D、酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D、1 mol甲基中电子数为10NA |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、常温常压下,16g CH4含有CH4分子数为NA |
| B、常温常压下,22.4L CO2含有CO2分子数为NA |
| C、1mol Na燃烧生成Na2O2失去的电子数为2NA |
| D、0.5mol?L-1的CuCl2溶液中含Cl-数为NA |
科学家从化肥厂生产的(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有SO42-和N4H44+两种离子,当N4H44+遇到碱性溶液时,会生成N4分子.下列说法正确的是( )
| A、14N、N4与N2互为同位素 |
| B、N4H4(SO4)2的电离方程式为N4H4(SO4)2?N4H44++2SO42- |
| C、NH4+与SO42-中心原子的杂化方式均为“sp3”杂化 |
| D、N4H4(SO4)2中只含有共价键,不含离子键 |
 铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题:
铜合金及铜的氯化物在生产生活中有着广泛的应用.请回答下列问题: