题目内容
下列叙述正确的是( )
| A、1molKOH的摩尔质量为56g |
| B、64gSO2中含有1molO2 |
| C、1molNH3的体积为22.4L |
| D、0.5molCO约含有3.01×1023个CO分子 |
考点:摩尔质量,气体摩尔体积
专题:
分析:A、依据n=
计算,质量单位为g;
B、依据n=
计算物质的量,二氧化硫分子是由原子构成;
C、温度压强不知其他条件不定;
D、依据n=
计算.
| m |
| M |
B、依据n=
| m |
| M |
C、温度压强不知其他条件不定;
D、依据n=
| N |
| NA |
解答:
解:A、KOH的摩尔质量为56g/mol,故A错误;
B、二氧化硫中不含氧气分子,64gSO2中物质的量=
=1mol,含有2molO,故B错误;
C、温度压强不知,1molNH3的体积不一定为22.4L,故C错误;
D、0.5molCO约含有CO分子=0.5mol×6.02×1023=3.01×1023个,故D正确;
故选D.
B、二氧化硫中不含氧气分子,64gSO2中物质的量=
| 64g |
| 64g/mol |
C、温度压强不知,1molNH3的体积不一定为22.4L,故C错误;
D、0.5molCO约含有CO分子=0.5mol×6.02×1023=3.01×1023个,故D正确;
故选D.
点评:本题考查了摩尔质量概念分析,气体摩尔体积应用条件的理解应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
与纯水的电离相似,液氨中存在着微弱的电离:2NH3═NH4++NH2-,据此判断以下叙述中错误的是( )
| A、液氨中含有NH3、NH4+、NH2- |
| B、一定温度下,液氨中,c(NH4+)?c(NH2-)是一个常数 |
| C、液氨的最离达到平衡时c(NH3)=c(NH4+)=c(NH2-) |
| D、只要不加入其他物质,液氨中一定有c(NH4+)=c(NH2-) |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D、1 mol甲基中电子数为10NA |
用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A、常温常压下,18gH2O所含原子数为NA |
| B、常温常压下,11.2L氧气含原子数为NA |
| C、2.3g金属钠变为钠离子失去0.1NA电子 |
| D、在同温同压时,相同体积的任何气体单质都含有相同数目的原子 |
科学家从化肥厂生产的(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有SO42-和N4H44+两种离子,当N4H44+遇到碱性溶液时,会生成N4分子.下列说法正确的是( )
| A、14N、N4与N2互为同位素 |
| B、N4H4(SO4)2的电离方程式为N4H4(SO4)2?N4H44++2SO42- |
| C、NH4+与SO42-中心原子的杂化方式均为“sp3”杂化 |
| D、N4H4(SO4)2中只含有共价键,不含离子键 |
下列化学用语正确的是( )
A、中子数为20的氯原子:
| ||||
| B、硫酸的电离方程式:H2SO4=H22++SO42- | ||||
| C、漂白粉的有效成分:CaCl2 | ||||
D、铝离子结构示意图: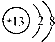 |
已知:6g碳不完全燃烧所得产物中,CO与CO2体积比为2:3,且C(s)+
O2(g)=CO(g)△H=-110kJ/mol;CO(g)+
O2(g)=CO2(g)△H=-283kJ/mol 与6g碳完全燃烧相比,损失的热量为( )
| 1 |
| 2 |
| 1 |
| 2 |
| A、283kJ |
| B、110kJ |
| C、196.5kJ |
| D、56.6kJ |