题目内容
制取500g HCl的质量分数为14.6%的盐酸:
(1)需要标准状况下HCl气体的体积是多少?
(2)已知该盐酸的密度为1.02g/cm3,则该盐酸的物质的量浓度是多少?
(1)需要标准状况下HCl气体的体积是多少?
(2)已知该盐酸的密度为1.02g/cm3,则该盐酸的物质的量浓度是多少?
考点:溶液中溶质的质量分数及相关计算,物质的量浓度的相关计算
专题:计算题
分析:(1)根据V=nVm=
Vm来计算体积的大小;
(2)根据c=
来计算物质的量浓度.
| m |
| M |
(2)根据c=
| 1000ρ×w% |
| M |
解答:
解:(1)V=nVm=
Vm=
×22.4L/mol=44.8L,答:需要标准状况下HCl气体的体积是44.8L;
(2)c=
=
=4.08mol/L,答:该盐酸的物质的量浓度是4.08mol/L.
| m |
| M |
| 500g×14.6% |
| 36.5g/mol |
(2)c=
| 1000ρ×w% |
| M |
| 1000×1.02g/cm3×14.6% |
| 36.5g/mol |
点评:本题涉及公式的计算,注意质量分数和物质的量浓度之间的关系以及有关物质的量的公式的灵活使用,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、71 g氯相当于2 mol氯 |
| B、每摩尔物质中含有6.02×1023个原子 |
| C、阿伏加德罗常数为12 g 12C所含的碳原子数 |
| D、1 mol KClO3中含有3 mol氧元素 |
以下有关元素性质的说法不正确的是( )
| A、具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是① |
| B、具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4,第一电离能最大的是③ |
| C、①Na、K、Rb ②O、S、Se ③Na、P、Cl,元素的电负性随原子序数增大而递增的是③ |
| D、某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D、1 mol甲基中电子数为10NA |
用NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A、常温常压下,18gH2O所含原子数为NA |
| B、常温常压下,11.2L氧气含原子数为NA |
| C、2.3g金属钠变为钠离子失去0.1NA电子 |
| D、在同温同压时,相同体积的任何气体单质都含有相同数目的原子 |
下列化学用语正确的是( )
A、中子数为20的氯原子:
| ||||
| B、硫酸的电离方程式:H2SO4=H22++SO42- | ||||
| C、漂白粉的有效成分:CaCl2 | ||||
D、铝离子结构示意图: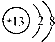 |
 洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.根据所学知识,回答下列问题:
洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一.漂白粉是常用的消毒剂.根据所学知识,回答下列问题: