题目内容
有关原电池和电解池的下列说法中不正确的是( )
| A、原电池负极发生氧化反应 |
| B、电解池阳极发生还原反应 |
| C、通电后,电解池中阳离子向阴极移动 |
| D、原电池中电子从负极沿导线流向正极 |
考点:原电池和电解池的工作原理
专题:
分析:原电池中正极发生还原反应,负极发生氧化反应,电子由负极流出,经导线流向正极;电解池中连接电源正极的为阳极,阴极连接电源负极,阳极发生氧化反应、阴极发生还原反应.
解答:
解:A.原电池中正极发生还原反应,负极发生氧化反应,故A正确;
B.电解池的阳极发生氧化反应、阴极发生还原反应,故B错误;
C.电解池中连接电源正极的为阳极,阴极连接电源负极,阳离子向阴极移动,阴离子向阳极移动,故C正确;
D.原电池中电子由负极流出,经导线流向正极,故D正确,
故选B.
B.电解池的阳极发生氧化反应、阴极发生还原反应,故B错误;
C.电解池中连接电源正极的为阳极,阴极连接电源负极,阳离子向阴极移动,阴离子向阳极移动,故C正确;
D.原电池中电子由负极流出,经导线流向正极,故D正确,
故选B.
点评:本题考查原电池、电解池工作原理,比较基础,注意对基础知识的理解掌握,侧重于电极反应和电子流向的考查.

练习册系列答案
相关题目
下列化合物中,在一定条件下既能发生取代反应,又能发生消去反应的是( )
| A、乙烯 | B、乙醇 | C、苯 | D、一氯甲烷 |
与纯水的电离相似,液氨中存在着微弱的电离:2NH3═NH4++NH2-,据此判断以下叙述中错误的是( )
| A、液氨中含有NH3、NH4+、NH2- |
| B、一定温度下,液氨中,c(NH4+)?c(NH2-)是一个常数 |
| C、液氨的最离达到平衡时c(NH3)=c(NH4+)=c(NH2-) |
| D、只要不加入其他物质,液氨中一定有c(NH4+)=c(NH2-) |
下列每组物质发生状态变化时所克服的微粒间的相互作用属于同种类型的是( )
| A、食盐和蔗糖熔化 |
| B、金刚石和硫熔化 |
| C、碘和干冰升华 |
| D、二氧化硅和氧化钠熔化 |
下列说法正确的是( )
| A、71 g氯相当于2 mol氯 |
| B、每摩尔物质中含有6.02×1023个原子 |
| C、阿伏加德罗常数为12 g 12C所含的碳原子数 |
| D、1 mol KClO3中含有3 mol氧元素 |
用Cl2生产某些含氯有机物时会产生副产物HC1.利用反应A,可实现氯的循环利用.判断下列说法正确的是( )
反应A:4HCl+O2
2Cl2+2H2O
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、
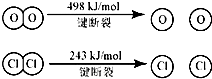
反应A:4HCl+O2
| CuO?CuCl2 |
| 400℃ |
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、

| A、反应A的△H>-115.6kJ/mol |
| B、断开1 mol H-O 键与断开 1 molH-Cl 键所需能量相差约为32kJ |
| C、H2O中H-O 键比HCl中H-Cl键弱 |
| D、由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D、1 mol甲基中电子数为10NA |