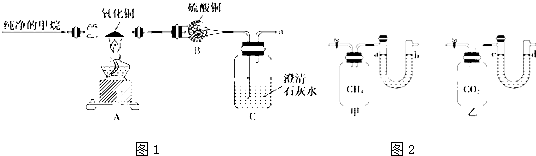
题目内容
下列物质的水溶液中,其电离方程式正确的是( )
| A、H2SO4=H2++SO42- |
| B、NaHSO4=Na++HSO4- |
| C、Na2CO3=2Na++CO32- |
| D、Ca(OH)2=Ca2++OH- |
考点:电离方程式的书写
专题:
分析:分清电解质的强弱,强电解质完全电离,用“═”,弱电解质部分电离,用可逆号,原子团在电离方程式中不能拆分,注意强酸的酸式酸根离子应电离出氢离子,并遵循电荷守恒、质量守恒定律.
解答:
解:A.硫酸为强电解质,完全电离,电离方程式为:H2SO4=2H++SO42-,故A错误;
B.NaHSO4为强电解质,在水溶液中完全电离生成钠离子、氢离子、硫酸根离子,电离方程式为:NaHSO4=Na++H++SO42-,故B错误;
C.Na2CO3为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,故C正确;
D.Ca(OH)2为强电解质,完全电离,电离方程式为:Ca(OH)2=Ca2++2OH-,故D错误;
故选:C.
B.NaHSO4为强电解质,在水溶液中完全电离生成钠离子、氢离子、硫酸根离子,电离方程式为:NaHSO4=Na++H++SO42-,故B错误;
C.Na2CO3为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,故C正确;
D.Ca(OH)2为强电解质,完全电离,电离方程式为:Ca(OH)2=Ca2++2OH-,故D错误;
故选:C.
点评:本题主要考查学生电离方程式的书写知识,明确电解质的强弱是解题关键,注意原子团不能拆,遵循电荷守恒、质量守恒定律.

练习册系列答案
相关题目
下列每组物质发生状态变化时所克服的微粒间的相互作用属于同种类型的是( )
| A、食盐和蔗糖熔化 |
| B、金刚石和硫熔化 |
| C、碘和干冰升华 |
| D、二氧化硅和氧化钠熔化 |
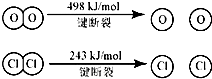
用Cl2生产某些含氯有机物时会产生副产物HC1.利用反应A,可实现氯的循环利用.判断下列说法正确的是( )
反应A:4HCl+O2
2Cl2+2H2O
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、
反应A:4HCl+O2
| CuO?CuCl2 |
| 400℃ |
已知:Ⅰ、反应A中,4mol HCI被氧化,放出115.6kJ的热量.
Ⅱ、

| A、反应A的△H>-115.6kJ/mol |
| B、断开1 mol H-O 键与断开 1 molH-Cl 键所需能量相差约为32kJ |
| C、H2O中H-O 键比HCl中H-Cl键弱 |
| D、由Ⅱ中的数据判断氯元素的非金属性比氧元素强 |
下列大小比较正确的是( )
| A、离子半径:Na+>Mg2+>Al3+>Cl-;原子半径:Na>Mg>Al>Cl |
| B、稳定性:HF>H2O>NH3>CH4; 还原性:HF<H2O<NH3<CH4 |
| C、碱性:CsOH>KOH>Mg(OH)2>NaOH; 金属性:Cs>K>Mg>Na |
| D、酸性:HClO>H2SO4>H2CO3;非金属性Cl>S>C |
NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A、5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
| B、12.5mL 16mol?L-1浓硫酸与足量铜反应,转移电子数为0.2NA |
| C、7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D、1 mol甲基中电子数为10NA |
科学家从化肥厂生产的(NH4)2SO4中检出化学式为N4H4(SO4)2的物质,该物质的晶体中含有SO42-和N4H44+两种离子,当N4H44+遇到碱性溶液时,会生成N4分子.下列说法正确的是( )
| A、14N、N4与N2互为同位素 |
| B、N4H4(SO4)2的电离方程式为N4H4(SO4)2?N4H44++2SO42- |
| C、NH4+与SO42-中心原子的杂化方式均为“sp3”杂化 |
| D、N4H4(SO4)2中只含有共价键,不含离子键 |