题目内容
3.下列说法正确的是( )| A. | 配制0.1mol/L CuSO4溶液100 mL,需称量CuSO4•5H2O 1.6g | |
| B. | 40g NaOH固体溶于1 L水,所得溶液的浓度为1 mol/L | |
| C. | 200mL 0.2mol/L MgCl2溶液中Cl-的个数为0.08NA | |
| D. | 从100mL 1mol/L H2SO4溶液取出10mL溶液,此溶液的浓度为0.1 mol/L |
分析 A.根据n=cV和m=nM计算CuSO4•5H2O 的质量;
B.溶液的体积不等于水的体积;
C.根据n=cV、N=nNA计算;
D.溶液中各部分的浓度相同.
解答 解:A.配制0.1mol/L CuSO4溶液100 mL,则硫酸铜的物质的量为n=cV=0.1mol/L×0.1L=0.01mol,所需CuSO4•5H2O 的质量为m=nM=0.01mol×250g/mol=2.5g,故A错误;
B.40g NaOH固体溶于1 L水,溶液的体积不等于水的体积,所以溶液的体积不是1L,溶液的体积不知,所以无法计算溶液的浓度,故B错误;
C.200mL 0.2mol/L MgCl2溶液中Cl-的物质的量为n=0.2mol/L×0.2L×2=0.08mol,则Cl-的个数为0.08NA,故C正确;
D.溶液中各部分的浓度相同,所以从100mL 1mol/L H2SO4溶液取出10mL溶液,此溶液的浓度为1 mol/L,故D错误.
故选C.
点评 本题考查了物质的量和物质的量浓度的计算,题目难度不大,侧重于考查学生的分析能力和计算能力,注意把握物质的量的有关公式.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
13.化学与社会、生活密切相关.下列说法正确的是( )
| A. | 用二氧化硫漂白纸浆、毛、丝、草帽辫等,是因为二氧化硫的还原性能使有色物质被氧化而褪色 | |
| B. | 过氧化钠用于呼吸面具作为氧气的来源,是因为过氧化钠具有强氧化性能氧化二氧化碳 壶水生成氧气 | |
| C. | 向盐碱地(含较多的NaCl、Na2C03)中施加适量石膏,可降低土壤的碱性,是因为石膏能与 Na2C03反应生成CaC03沉淀 | |
| D. | 在被保护的锅炉内壁,装上镁合金或锌块,以减少锅炉的腐蚀,是因为镁、锌比铁活泼,这样连接使锅炉做为原电池的负极被保护下来 |
14.在4mol/L的硫酸和2mol/L的硝酸混合溶液10mL中,加入0.96g铜粉,充分反应后,最多可以收集到的标准状况下的气体体积为( )[提示:稀硝酸和铜粉的化学反应为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O].
| A. | 112 mL | B. | 224 mL | C. | 448 mL | D. | 560 mL |
8.CuO、Fe粉、Fe3O4的混合物中,加一定量稀硫酸,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,片刻后.取出铁钉,观察现象.以下结论中正确的是( )
| A. | 若铁钉部分溶解,则滤液中一定含Fe2(SO4)3 | |
| B. | 若铁钉完全溶解,则滤液中一定含CuSO4 | |
| C. | 若铁钉表面有红色物质生成,则不溶物中一定不含Fe | |
| D. | 若铁钉无变化,则不溶物中一定含Fe |
15.下列叙述或表示正确的是( )
| A. | 0.1mol•L-1的醋酸的pH=a,0.01mol•L-1的醋酸的pH=b,则a+1=b | |
| B. | 用200mL 4mol•L-1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为:3CO2+4OHˉ═CO32ˉ+2HCO3ˉ+H2O | |
| C. | 难溶电解质AB2的饱和溶液中,c(A2+)=xmol•L-1,c(B-)=y mol•L-1,则Ksp值为4xy2 | |
| D. | 常温下0.1mol•L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COOˉ)=0.1 mol•L-1 |
 .
.
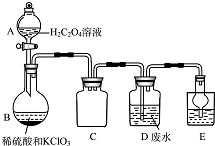 ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题:
ClO2是一种国际上公认的安全无毒的绿色水处理剂.回答下列问题: