题目内容
16.已知H2B在水溶液中存在以下电离,请回答以下问题:一级电离:H2B?H++HB-,二级电离:HB-?H++B2-
(1)NaHB溶液无法确定(填“呈酸性”、“呈碱性”或“无法确定”).
(2)某温度下,在0.1mol•L-1的NaHB溶液中,以下关系一定不正确的是CD
A.c(H+)•c(OH-)=1×10-14 B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+) D.c(Na+)=0.1mol•L-1≥c(B2-)
(3)某温度下,FeB(s)?Fe2+(aq)+B2-(aq)的平衡常数表达式为K=c(Fe2+)•c(B2-)
KSP=c(Fe2+)•c(B2-),FeB在水中的沉淀溶解平衡曲线如图所示.下列说法错误的是CD
A.a点对应的KSP等于b点对应的KSP
B.d点无沉淀生成
C.可以通过升温实现由c点变到a点
D.此温度下,KSP=4×10-18

(4)若B2-为S2-,则Na2S中各项关系一定正确的是ABC
A、c(Na+)>c(S2-)>c(OH-)>c(HS-) B、c(Na+)+c(H+)=c(HS-)+2c(S2-)+c(OH-)
C、c(Na+)=2c(HS-)+2c(S2-)+2c(H2S) D、c(OH-)=c(H+)+c(HS-)
(5)若0.1mol•L-1的H2B溶液在常温下的pH=3,c(B2-)=1×10-6mol•L-1,则H2B的一级电离的Ka1为10-5 Na2B的Kh10-9.
分析 (1)HB-在水溶液中存在电离平衡和水解平衡两种,电离时显酸性,水解时显碱性;
(2)A.根据水的离子积与温度的关系判断;
B.根据盐类的水解判断;
C.根据溶液中氢氧根离子的来源判断C;
D.根据盐类的水解判断;
(3)根据电离方程式书写,固体不能写入平衡常数表达式;
A.根据溶度积与温度的关系判断;
B.根据QC与KSP的关系判断;
C.根据外界条件对溶度积的影响判断;
D.根据KSP与FeB溶解度的关系判断;
(4)Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,且硫离子第一步水解程度远远大于第二步水解程度,该溶液中存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断离子浓度大小;
(5)若0.1mol•L-1的H2B溶液中,一级电离:H2B?H++HB-,二级电离:HB-?H++B2-,根据Ka1=$\frac{c(H{B}^{-})•c({H}^{+})}{c({H}_{2}B)}$计算;Na2B的Kh=$\frac{K{a}_{1}}{{K}_{W}}$.
解答 解:(1)HB-在水溶液中存在电离平衡和水解平衡两种,以电离为主时,溶液显酸性,以水解为主时,溶液显碱性,所以无法确定NaHB溶液的酸碱性,
故答案为:无法确定;
(2)A.水的离子积常数与温度有关,与溶液的酸碱性、浓度无关,所以A可能正确,故A不选;
B.此溶液是强碱弱酸盐,水解溶液呈碱性,pH值可能>7,所以B可能正确,故B不选;
C.电荷守恒得c(H+)+c(Na+)=c(OH-)+2c(B2-)+c(HB-),物料守恒得c(Na+)=c(H2B)+c(B2-)+2c(HB-),所以得c(H+)+c(H2B)=c(OH-)+c(B2-),即C(OH-)=C(H2B)+C(H+)-c(B2-),故C选;
D.由于弱离子的水解,所以C(HB-)<0.1mol/L,故D选;
故答案为:CD;
(3)某温度下,FeB(s)?Fe2+(aq)+B2-(aq)的平衡常数表达式为K=c(Fe2+)•c(B2-);
A.在沉淀溶解平衡曲线上的点表示的Ksp相等,点对应的KSP等于b点对应的KSP,故A正确;
B.在d点,还未达到FeB的Ksp,则不会生成沉淀,故B正确;
C.Ksp受温度影响,升温时,Ksp会发生变化,则通过升温不可能由c点变到a点,故C错误;
D.此温度下,KSP=c(Fe 2+ )•c(B 2- )=2×10-9×10-9=2×10-18,故D错误;
故答案为:CD;
(4)A.Na2S是强碱弱酸盐,硫离子水解导致溶液呈碱性,且硫离子第一步水解程度远远大于第二步水解程度,硫离子两步水解和水电离都生成氢氧根离子,硫离子第一步水解生成硫氢根离子,所以该溶液中离子浓度大小顺序是c(Na+)>c(S2-)>c(OH-)>c(HS-),故A正确;
B.该物质溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),故B正确;
C.根据物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),故C正确;
D.根据物料守恒得c(Na+)=2c(S2-)+2c(H2S)+2c(HS-),根据电荷守恒得c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),所以得c(OH-)=c(HS-)+c(H+)+2c(H2S),故D错误;
故答案为:ABC;
(5)若0.1mol•L-1的H2B溶液中,一级电离:H2B?H++HB-,二级电离:HB-?H++B2-,Ka1=$\frac{c(H{B}^{-})•c({H}^{+})}{c({H}_{2}B)}$=$\frac{1{0}^{-3}×1{0}^{-3}}{0.1}$=10-5;Na2B的Kh=$\frac{K{a}_{1}}{{K}_{W}}$=$\frac{1{0}^{-5}}{1{0}^{-14}}$=10-9;
故答案为:10-5;10-9.
点评 本题考查的是弱电解质的电离平衡及难溶电解质的溶解平衡,题目难度中等,考查学生分析图象及结合图象分析问题、解决问题的能力,能正确分析图象是解决(3)题的关键.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案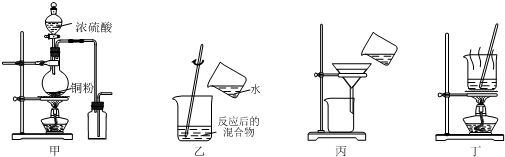
| A. | 用图甲装置制取并收集二氧化硫 | |
| B. | 用图乙装置向反应后的混合物中加水稀释 | |
| C. | 用图丙装置过滤出稀释后混合物中的不溶物 | |
| D. | 用图丁装置将硫酸铜溶液蒸发浓缩后冷却结晶 |
| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由强至弱的顺序是X>Y>Z | |
| C. | 原子半径大小顺序是X>Y>Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |
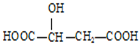 ,下列说法正确的是( )
,下列说法正确的是( )| A. | HOOC-CH2-CH(OH)-COOH与苹果酸互为同分异构体 | |
| B. | 1mol苹果酸可与3mol NaOH发生中和反应 | |
| C. | 1mol苹果酸与足量金属Na反应生成生成1mol H2 | |
| D. | 苹果酸中能发生酯化反应的官能团有2种 |
①甲单质比乙单质更容易与H2化合;
②甲单质能与乙的阴离子发生置换反应;
③甲的最高价氧化物对应的水化物酸性比乙的最高价氧化物对应的水化物酸性强;
④与某金属反应时,甲原子得电子数目比乙的多;
⑤甲的单质熔、沸点比乙的低.
| A. | 只有④ | B. | 只有①②③ | C. | ①②③⑤ | D. | ①②③④⑤ |
| A. | 钢 | B. | 液氯 | C. | 玻璃 | D. | 氨水 |
 的系统命名是2,3-二甲基-1,3-戊二烯;
的系统命名是2,3-二甲基-1,3-戊二烯;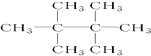 ,名称是2,2,3,3-四甲基丁烷;
,名称是2,2,3,3-四甲基丁烷; ;
; 的结构简式CH2=CH(CH3)COOHCH3.
的结构简式CH2=CH(CH3)COOHCH3. 、其最高价氧化物对应的水化物的化学式H3PO4.
、其最高价氧化物对应的水化物的化学式H3PO4.