题目内容
12.下列叙述中一定能说明A的金属性比B强的是( )| A. | A原子的最外层电子数比B原子的最外层电子数少 | |
| B. | 常温时,A能从盐酸中置换出氢气,而B不能反应 | |
| C. | B不能从溶液中置换出A | |
| D. | 1 mol A失去的电子比1 mol B失去的电子多 |
分析 比较元素的金属性,可通过①最高价氧化物的水化物的碱性强弱;②与水或酸反应的剧烈程度;③金属之间的置换反应等角度判断.
解答 解:A.金属性强弱和原子的最外层电子数无关,如氢原子最外层只有一个电子,而镁原子最外层两个电子,镁的金属性更强,故A错误;
B.常温下,A能和稀盐酸发生置换反应,B不能反应,说明在金属活动性顺序表中A位于H之前、B位于H之后,所以金属性A>B,故B正确;
C.B不能从溶液中置换出A,但不能说明金属性A>B,如钠金属性大于Cu,但钠和铜盐溶液混合时先和水反应,得不到Cu,故C错误;
D.失电子多少与金属性强弱无关,所以不能说明金属性A大于B,故D错误;
故选B.
点评 本题考查金属性强弱判断,为高频考点,明确金属性强弱与失电子多少无关、与失电子难易程度有关是解本题关键,注意规律中的反常现象,易错选项是C.

练习册系列答案
相关题目
2.下列关于化学键的说法正确的是( )
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 金属和非金属化合时一定形成离子键 | |
| D. | 含有共价键的化合物都是共价化合物 |
3.现行的长式周期表,由左到右为18列,碱金属族为第1列,稀有气体为第18列.按这个规定,下列说法中错误的是( )
| A. | 过渡元素包括七个副族和第Ⅷ族的元素 | |
| B. | 第3列中元素种类最多 | |
| C. | 第17列的第一种元素对应最高价氧化物的水化物是最强的含氧酸 | |
| D. | 第15列元素的氢化物组成通式可用RH3表示 |
20.在盛有水的电解槽中加入含等物质的量的Ag+,Pb2+,K+,SO42-,NO3-,Br-的物质,充分搅拌,然后用惰性电极电解,通电片刻后,氧化产物和还原产物的物质的量之比为( )
| A. | 1:2 | B. | 8:1 | C. | 1:1 | D. | 80:108 |
17.下列化合物的1H-NMR谱图中吸收峰数目正确的是( )
| A. | CH3CH2CH2CH3(3个) | B. | 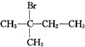 (2个) (2个) | ||
| C. | CH2=CH-CH2CH3(3个) | D. | 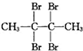 (1个) (1个) |
4.X、Y、Z三种元素的原子具有相同的电子层数,它们的最高价氧化物的水化物酸性由强至弱的顺序是H3XO4<H2YO4<HZO4,则下列说法正确的是( )
| A. | 原子序数X>Y>Z | |
| B. | 元素的非金属性由强至弱的顺序是X>Y>Z | |
| C. | 原子半径大小顺序是X>Y>Z | |
| D. | 气态氢化物的稳定性H3X>H2Y>HZ |
2.A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z.下列说法正确的是( )
| A. | X、Y、Z的稳定性逐渐减弱 | |
| B. | A、B、C、D只能形成5种单质 | |
| C. | X、Y、Z三种化合物的熔沸点逐渐升高 | |
| D. | 由A、B、C、D四元素间形成的化合物中只含共价键,不含离子键 |
 的系统命名是2,3-二甲基-1,3-戊二烯;
的系统命名是2,3-二甲基-1,3-戊二烯;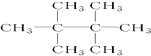 ,名称是2,2,3,3-四甲基丁烷;
,名称是2,2,3,3-四甲基丁烷; ;
; 的结构简式CH2=CH(CH3)COOHCH3.
的结构简式CH2=CH(CH3)COOHCH3.