题目内容
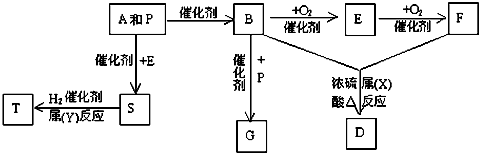
A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大.A原子无中子,B、G原子的最外层电子数均为其电子层数的两倍,D、G元素原子的最外层电子数相等.X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应(相对分子质量甲<乙)转化关系如图(反应条件略去),原子E最外层电子数和其电子层数相等.元素F形成的单质是“21世纪的能源”,是目前应用最多的半导体材料.请回答下列问题:
(1)A和F两元素形成的化合物是 极性分子、非极性分子).A2D的熔沸点比A2G高的原因是 .B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 .
(2)E4B3和水反应的化学方程式 .
(3)写出M与甲的浓溶液加热时反应的化学方程式 .
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为 ;X、Y、W都能与Z反应,则Z的结构式为 .
(5)化合物FD2与元素B形成的某种单质晶体类型相同,且在高温下能发生置换反应.若反应中B的单质被破坏1mol共价键,参加反应的化合物FD2的质量为 g.

(1)A和F两元素形成的化合物是
(2)E4B3和水反应的化学方程式
(3)写出M与甲的浓溶液加热时反应的化学方程式
(4)X、Y、Z、W属于同一类物质,这类化合物固态时的晶体类型为
(5)化合物FD2与元素B形成的某种单质晶体类型相同,且在高温下能发生置换反应.若反应中B的单质被破坏1mol共价键,参加反应的化合物FD2的质量为
考点:位置结构性质的相互关系应用,无机物的推断
专题:推断题,元素周期律与元素周期表专题
分析:A、B、C、D、E、F、G七种元素均是短周期元素,且原子序数依次增大.A原子无中子,则A为氢元素,B、G原子的最外层电子数均为其电子层数的两倍,分别为碳和硫,由于G的原子序数大于B,所以B为碳,G为硫,D、G元素原子的最外层电子数相等,为同主族元素,则D为氧元素,C的原子序数介于B、D之间,所以C为氮元素,X、Y、Z、W、甲、乙六种物质均由上述元素的两种或三种元素组成,元素B形成的单质M与甲、乙(甲、乙是高中常见的浓酸)均能反应,则甲、乙分别为浓硝酸和浓硫酸,相对分子质量甲<乙,所以甲为浓硝酸,乙为浓硫酸,由转化关系图可知,X为NO2,W为SO2,原子E最外层电子数和其电子层数相等,原子序数小于G,则E为铝元素,元素F形成的单质是“21世纪的能源”,是目前应用最多的半导体材料,则F为硅元素,据此解答各题即可.
解答:
解:依据分析可知:A为氢,B为碳,C为氮,D为氧,E为铝,F为硅,G为硫,
(1)H和Si两元素形成的化合物是硅烷,硅烷是由极性共价键形成的非极性分子,因为水分子间存在氢键,所以水的熔沸点比硫化氢高,B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是 ,故答案为:非极性分子;水分子间存在氢键;
,故答案为:非极性分子;水分子间存在氢键; ;
;
(2)E4B3为Al4C3,它和水反应的化学方程式为Al4C3+6H2O=4Al(OH)3↓+3CH4↑,故答案为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑;
(3)碳与浓硝酸加热时反应的化学方程式为C+4HNO3(浓)
CO2↑+4NO2↑+2H2O,
故答案为:C+4HNO3(浓)
CO2↑+4NO2↑+2H2O;
(4)NO2、SO2、CO2、H2O属于同一类物质,这类化合物固态时的晶体类型为都为分子晶体,X、Y、W都能与Z反应,则Z为水,它的结构式为H-O-H,故答案为:分子晶体;H-O-H;
(5)化合物SiO2与元素C形成的某种单质晶体类型相同,即原子晶体,1molC中含有2mol共价键,在高温下能发生置换反应为:SiO2+2C
Si+2CO,反应中C的单质被破坏1mol共价键,即有0.5molC反应,参加反应的化合物SiO2的质量为:
×60g/mol=15g,故答案为:15.
(1)H和Si两元素形成的化合物是硅烷,硅烷是由极性共价键形成的非极性分子,因为水分子间存在氢键,所以水的熔沸点比硫化氢高,B、D、G各一个原子构成每原子均满足8电子的分子,其电子式是
 ,故答案为:非极性分子;水分子间存在氢键;
,故答案为:非极性分子;水分子间存在氢键; ;
;(2)E4B3为Al4C3,它和水反应的化学方程式为Al4C3+6H2O=4Al(OH)3↓+3CH4↑,故答案为:Al4C3+12H2O=4Al(OH)3↓+3CH4↑;
(3)碳与浓硝酸加热时反应的化学方程式为C+4HNO3(浓)
| ||
故答案为:C+4HNO3(浓)
| ||
(4)NO2、SO2、CO2、H2O属于同一类物质,这类化合物固态时的晶体类型为都为分子晶体,X、Y、W都能与Z反应,则Z为水,它的结构式为H-O-H,故答案为:分子晶体;H-O-H;
(5)化合物SiO2与元素C形成的某种单质晶体类型相同,即原子晶体,1molC中含有2mol共价键,在高温下能发生置换反应为:SiO2+2C
| ||
| 1 |
| 4 |
点评:本题主要考查了电子式、化学反应方程式、分子结构、化学键等知识点,中等难度,解题的关键在于根据原子结构及物质性质确定元素及化合物种类.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
3元素的离子RX-、Mn+、Zm+有相同的电子层结构,已知n>m它们对应的原子序数关系为( )
| A、R>M>Z |
| B、M>R>Z |
| C、M>Z>R |
| D、Z>M>R |
三甲基一氯硅[(CH3)3SiCl]是一种生产有机硅化合物的原料,遇明火或氧化剂会引起爆炸,在空气中燃烧生成一氧化碳、二氧化碳、二氧化硅和氯化氢,另外与水接触可产生盐酸.下列说法错误的是( )
| A、保存三甲基一氯硅时应密封防水 |
| B、扑灭三甲基一氯硅引发的着火,应使用二氧化碳、干粉灭火剂,并用弱碱性水处理 |
| C、三甲基一氯硅水溶液pH小于7 |
| D、三甲基一氯硅由碳、氢、硅、氯四个原子构成 |