题目内容
碳酸钠与工农业生产、日常生活紧密相关.工业碳酸钠大多采用侯氏制碱法制取,所得碳酸钠样品中往往含有少量NaCl,现欲测定样品中Na2CO3的质量分数,某探究性学习小组分别设计了如下实验方案.请回答下列有关问题:
方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀 (填操作)、洗涤、烘干、称量,判断沉淀已洗涤干净的操作是 .
方案二:气体分析法
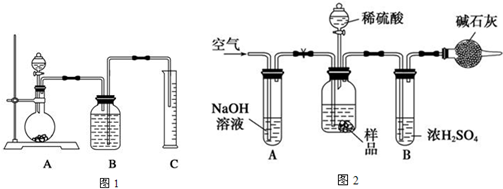
(2)把一定量的样品与足量盐酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用 装置A中发生反应的离子方程式为
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用下图所示装置,通过称量反应前后盛有碱石灰的干燥管的质量,利用其质量差求算样品的纯度.
该实验的操作步骤有:
①取ng样品装入广口瓶中,打开止水夹,缓慢鼓入空气数分钟,
②关闭止水夹,在干燥管内填满碱石灰,质量为mg,
③缓慢加入稀硫酸至不再产生气体为止,
④打开止水夹缓慢鼓入空气数分钟,再称量干燥管质量为wg
Ⅰ、装置组装完成后,进行步骤①前还必要进行的操作为
Ⅱ、装置B的作用是 若去掉装置A,测定结果
Ⅲ、根据上述数据可以计算出样品中Na2CO3的质量分数为 (用字母表示)

方案一:沉淀分析法
(1)把一定质量的样品溶解后加入过量的CaCl2溶液,将所得沉淀
方案二:气体分析法
(2)把一定量的样品与足量盐酸反应后,用下图所示装置测定产生CO2的体积,为了确保测定结果的准确性,B中的溶液最好采用
方案三:质量差分析法
(3)把一定质量的样品和足量的稀硫酸反应,采用下图所示装置,通过称量反应前后盛有碱石灰的干燥管的质量,利用其质量差求算样品的纯度.
该实验的操作步骤有:
①取ng样品装入广口瓶中,打开止水夹,缓慢鼓入空气数分钟,
②关闭止水夹,在干燥管内填满碱石灰,质量为mg,
③缓慢加入稀硫酸至不再产生气体为止,
④打开止水夹缓慢鼓入空气数分钟,再称量干燥管质量为wg
Ⅰ、装置组装完成后,进行步骤①前还必要进行的操作为
Ⅱ、装置B的作用是
Ⅲ、根据上述数据可以计算出样品中Na2CO3的质量分数为
考点:探究物质的组成或测量物质的含量
专题:
分析:(1)测定样品中Na2CO3的质量分数,样品溶解后加入过量的CaCl2溶液会生成沉淀,分离方法为过滤,洗涤沉淀的操作是在过滤器中加水浸没沉淀使水自然留下,洗涤干净的方法是取最后一次洗涤液检验是否含有氯离子设计检验;
(2)把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积进行计算,广口瓶中液体是饱和碳酸氢钠;装置中二氧化碳和氢氧化钠溶液反应生成碳酸钠和水;
(3)Ⅰ、依据装置图分析气体通过需要先检查装置气密性;
Ⅱ、若去掉装置A,空气中的二氧化碳会被碱石灰吸收,测定结果偏高,装置B是吸收二氧化碳气体中的水蒸气;
Ⅲ、称取n g样品装入广口瓶中,打并止水夹,缓慢鼓入空气数分钟用来赶净装置中的空气,关闭止水夹,在干燥管内填满碱石灰,质量为m g,缓慢加入稀硫酸至不再产生气体为止,打开止水夹,缓慢鼓入空气数分钟,把生成的二氧化碳全部赶到碱石灰干燥管中全部吸收,再称量干燥管质量为w g计算;
(2)把一定量的混合物与足量盐酸反应,然后用如图装置测定产生的CO2气体的体积,是利用排液法测定生成二氧化碳的气体体积进行计算,广口瓶中液体是饱和碳酸氢钠;装置中二氧化碳和氢氧化钠溶液反应生成碳酸钠和水;
(3)Ⅰ、依据装置图分析气体通过需要先检查装置气密性;
Ⅱ、若去掉装置A,空气中的二氧化碳会被碱石灰吸收,测定结果偏高,装置B是吸收二氧化碳气体中的水蒸气;
Ⅲ、称取n g样品装入广口瓶中,打并止水夹,缓慢鼓入空气数分钟用来赶净装置中的空气,关闭止水夹,在干燥管内填满碱石灰,质量为m g,缓慢加入稀硫酸至不再产生气体为止,打开止水夹,缓慢鼓入空气数分钟,把生成的二氧化碳全部赶到碱石灰干燥管中全部吸收,再称量干燥管质量为w g计算;
解答:
解:(1)测定样品中Na2CO3的质量分数,样品溶解后加入过量的CaCl2溶液会生成沉淀,分离方法为过滤,洗涤沉淀的操作是在过滤器中加水浸没沉淀使水自然留下,取最后一次洗涤液,滴入硝酸银溶液物白色沉淀生成证明沉淀已洗涤干净;
故答案为:过滤,取最后一次洗涤液,滴入硝酸银溶液物白色沉淀生成证明沉淀已洗涤干净;
(2)利用测定反应生成的二氧化碳气体体积的方法测定,在碳酸氢钠溶液中二氧化碳不反应,溶解度减小,利用装置图排饱和碳酸氢钠溶液测定二氧化碳气体的体积,装置A中发生反应的离子方程式为:CO2+2OH-=CO32-+H2O;
故答案为:饱和碳酸氢钠溶液;CO2+2OH-=CO32-+H2O;
(3)Ⅰ、依据装置图分析,结合操作顺序中的给定步骤位置,装置组装完成后,进行步骤①前还必要进行的操作为:先检查装置气密性;
故答案为:检查装置气密性;
Ⅱ、装置B的作用是气体中的水蒸气被除去;若去掉装置A,空气中的二氧化碳会被碱石灰吸收,测定结果偏高;
故答案为:偏大;除去二氧化碳气体中混有的水蒸气;
Ⅲ、①取ng样品装入广口瓶中,打开止水夹,缓慢鼓入空气数分钟,
②关闭止水夹,在干燥管内填满碱石灰,质量为mg,
③缓慢加入稀硫酸至不再产生气体为止,
④打开止水夹缓慢鼓入空气数分钟,再称量干燥管质量为wg
样品中Na2CO3的质量分数=
×100%=
×100%;
故答案为:
×100%;
故答案为:过滤,取最后一次洗涤液,滴入硝酸银溶液物白色沉淀生成证明沉淀已洗涤干净;
(2)利用测定反应生成的二氧化碳气体体积的方法测定,在碳酸氢钠溶液中二氧化碳不反应,溶解度减小,利用装置图排饱和碳酸氢钠溶液测定二氧化碳气体的体积,装置A中发生反应的离子方程式为:CO2+2OH-=CO32-+H2O;
故答案为:饱和碳酸氢钠溶液;CO2+2OH-=CO32-+H2O;
(3)Ⅰ、依据装置图分析,结合操作顺序中的给定步骤位置,装置组装完成后,进行步骤①前还必要进行的操作为:先检查装置气密性;
故答案为:检查装置气密性;
Ⅱ、装置B的作用是气体中的水蒸气被除去;若去掉装置A,空气中的二氧化碳会被碱石灰吸收,测定结果偏高;
故答案为:偏大;除去二氧化碳气体中混有的水蒸气;
Ⅲ、①取ng样品装入广口瓶中,打开止水夹,缓慢鼓入空气数分钟,
②关闭止水夹,在干燥管内填满碱石灰,质量为mg,
③缓慢加入稀硫酸至不再产生气体为止,
④打开止水夹缓慢鼓入空气数分钟,再称量干燥管质量为wg
样品中Na2CO3的质量分数=
| ||
| n |
| 53(w-m) |
| 22n |
故答案为:
| 53(w-m) |
| 22n |
点评:本题考查了物质性质的探究和组成分析判断,主要是实验过程的分析,掌握基本操作时解题关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法错误的是( )
| A、纯碱不是碱,溶液显碱性 |
| B、双氧水不是水,不可以饮用 |
| C、干冰不是冰,常作致冷剂 |
| D、醋酸不是酸,能被碱中和 |
火法炼铜得到的粗铜中含多种杂质(如锌、金和银等),其性能远不能达到电气工业的要求,工业上常用电解精炼法将粗铜提纯.在电解精炼时( )
| A、粗铜接电源负极 |
| B、精铜作阴极 |
| C、杂质都将以单质形式沉积到池底 |
| D、精铜片增重2.56g,电路中通过电子为0.04mol |
25℃时,下列各溶液中有关物质的量浓度关系正确的是( )
| A、pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| B、Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、NH4HSO4溶液中滴加NaOH至溶液恰好呈中性:c(Na+)>c(SO42-)>c(OH-)=c(H+) |
| D、pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(NaOH )>c(CH3COONa)>c(Na2CO3)>c(C6H5ONa ) |
下列实验操作正确的是( )
A、 酸式滴定管排气泡 |
B、 配制100 mL 0.01mol/L盐酸 |
C、 测定中和热 |
D、 石油的分馏 |