题目内容
6.用沉淀法测定 KHCO3和 Na2CO3 固体混合物的组成,每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的 Ba(OH)2 溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见表:| 实验序号 | I | II | III | IV | Ⅴ |
| 样品质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.91 | 11.82 | 17.73 | 23.64 | 23.64 |
(1)样品中KHCO3和Na2CO3 的物质的量之比2:1.
(2)室温下第III组实验所得溶液中的 OH-物质的量浓度为0.6mol/L.
分析 (1)第III次实验中样品完全反应,令KHCO3和Na2CO3 的物质的量分别为xmol、ymol,根据碳元素守恒可知沉淀碳酸钡的物质的量为(x+y)mol,根据样品质量与碳酸钡沉淀质量列方程计算;
(2)第III组实验反应后溶液为氢氧化钡、氢氧化钠、氢氧化钾的混合溶液,由钡离子守恒计算溶液中钡离子物质的量,由钠离子守恒可知,溶液中n(KOH)=n(KHCO3),由钾离子守恒可知,溶液中n(NaOH)=2n(Na2CO3),根据溶液中氢氧化钡、氢氧化钠、氢氧化钾的物质的量计算氢氧根的浓度.
解答 解:(1)第III次实验中样品完全反应,令KHCO3和Na2CO3 的物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{100x+106y=9.18}\\{197x+197y=17.73}\end{array}\right.$,.解得x=0.06,y=0.03,
故n(KHCO3):n(Na2CO3 )=0.06mol:0.03mol=2:1,
故答案为:2:1;
(2)分析可知,第IV次恰好样品完全反应,碳酸钡物质的量=$\frac{23.64g}{197g/mol}$=0.12mol,根据钡离子守恒,300mL氢氧化钡溶液中氢氧化钡的物质的量=0.12mol,
第III组实验反应后溶液为氢氧化钡、氢氧化钠、氢氧化钾的混合溶液,17.73g碳酸钡的物质的量为$\frac{17.73g}{197g/mol}$=0.09mol,由钡离子守恒可知,溶液中n[Ba(OH)2]=0.12mol-0.09mol=0.03mol,
由钾离子守恒可知,溶液中n(KOH)=n(KHCO3)=0.06mol,由钠离子守恒可知,溶液中n(NaOH)=2n(Na2CO3)=2×0.03mol=0.06mol,
所以溶液中n(OH-)=2n[Ba(OH)2]+n(NaOH)+n(KOH)=0.03mol×2+0.06mol+0.06mol=0.18mol,第3组实验所得溶液中的OH-浓度为$\frac{0.18mol}{0.3L}$=0.6mol/L,
故答案为:0.6mol/L.
点评 本题考查混合物的计算、实验数据分析处理等,综合性较大,难度较大,旨在考查学生的综合能力,是一道不错的能力考查题.

| A. | 黑火药由硝石、硫磺、木炭按一定比例混合制成,其中“硝石”指的是硝酸钾 | |
| B. | “青篙一握,以水二升渍,绞取汁”,该挺取青蒿素的过程属于化学变化 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合反应 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
| A. | Fe与A1的物质的量之比为1:1 | |
| B. | 混合气体中 NO为0.03mol,N2O0.12mol | |
| C. | 原HNO3溶液的浓度C=4.6mol/L | |
| D. | 反应中被还原的HNO3为0.18 mol |
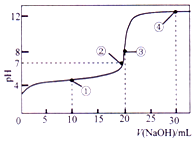 常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000mol•L-1NaOH 溶液滴定 20.00mL 0.1000mol•L-1的 CH3COOH 溶液所得滴定曲线如图.下列说法正确的是( )| A. | 点①所示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-) | |
| B. | 点②所示溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| C. | 点③所示溶液中:c(H+)=c(CH3COOH)+c(OH-) | |
| D. | 点④所示溶液中:2c(OH-)-2c(H+)=c(CH3COO-)+3c(CH3COOH) |
| A. | 1.00mol NaCl中含有NA个NaCl 分子 | |
| B. | 常温常压下,22.4LCl2与足量镁粉反应,转移的电子数为2NA | |
| C. | 一定条件下,2.3gNa与足量O2完全反应生成3.6g产物时失去的电子数为0.1NA | |
| D. | 28g乙烯和环丙烷(C3H6)组成的混合气体中含有氢原子的个数为3 NA |
| A. | 氮气 | B. | 硫化氢 | C. | 氨气 | D. | 氮的氧化物 |
①聚乙烯塑料的老化是因为发生了加成反应
②利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程
③淀粉、油脂、蛋白质在一定条件下都能发生水解反应
④石油的分馏和煤的干馏都是发生了化学变化
⑤单糖、二糖都能与新制Cu(OH)2发生反应
⑥向蛋白质溶液中滴加饱和NaCl溶液或CuSO4溶液,均有固体析出.
| A. | ①②③④⑤ | B. | ②③⑥ | C. | ②③④⑤ | D. | ②⑤⑥ |
 的一氯代物有( )
的一氯代物有( )| A. | 5种 | B. | 6种 | C. | 7种 | D. | 8种 |
 (或
(或
 ).
).