题目内容
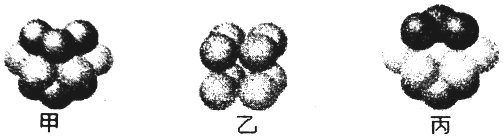
11.随原子序数递增,八种短周期元素(用字母x…表示)原子半径的相对大小、最高正价或最低负价的变化如图1所示.根据判断出的元素回答问题:
(1)f在周期表中的位置是第三周期ⅢA族.
(2)(用化学式表示):比较g、h的最高价氧化物对应水化物的酸性强弱:HClO4>H2SO4
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:
 (或
(或
 ).
).(4)上述元素可组成盐R:zx4f(gd4)2.向盛有10mL 1mol•L-1R溶液的烧杯中滴加1mol•L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化示意图如图2:
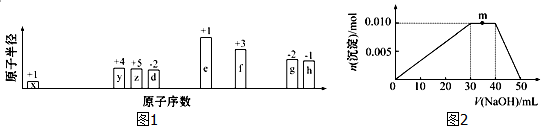
①写出m点反应的离子方程式:NH4++OH-=NH3•H2O.
②若在R溶液中改加20mL 1.2mol•L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为0.022mol.
分析 从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族;
(2)非金属性越强,最高价氧化物水化物的酸性越强;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等;
(4)①m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O;
②根据n=cV计算n(Al3+ )、n(NH4+)、n(SO42-)、n(Ba2+)、n(OH-),根据SO42-、Ba2+中不足量的离子的物质的量计算生成BaSO4的物质的量,依次发生:Al3++OH-=Al(OH)3↓、NH4++OH-=NH3•H2O、Al(OH)3+OH-=AlO2-+2H2O,根据方程式计算生成Al(OH)3的物质的量,进而二者计算生成固体总物质的量.
解答 解:从图中的化合价和原子半径的大小,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素.
(1)f是Al元素,在元素周期表的位置是第三周期ⅢA族,故答案为:第三周期ⅢA族;
(2)非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为 (或
(或
 ),
),
故答案为: (或
(或
 );
);
(4)①m点过程中加入氢氧化钠,沉淀物质的量不变,是NH4+与OH-反应生成NH3•H2O,离子方程式为NH4++OH-=NH3•H2O,
故答案为:NH4++OH-=NH3•H2O;
②10mL 1mol•L-1 NH4Al(SO4)2溶液中Al3+ 物质的量为0.01mol,NH4+的物质的量为0.01mol,SO42-的物质的量为0.02mol,20mL 1.2 mol•L-1Ba(OH)2溶液中Ba2+物质的量为0.024mol,OH-为0.048mol,
由SO42-+Ba2+=BaSO4↓,可知SO42-不足,故可以得到0.02mol BaSO4,
Al3++3OH-=Al(OH)3↓
0.01mol 0.03mol 0.01mol
反应剩余OH-为0.048mol-0.03mol=0.018mol,
NH4++OH-=NH3•H2O
0.01mol 0.01mol
反应剩余OH-为0.018mol-0.01mol=0.008mol,
Al(OH)3+OH-=AlO2-+2H2O
0.008mol 0.008mol
故得到Al(OH)3沉淀为0.01mol-0.008mol=0.002mol
则最终得到固体为0.02mol+0.002mol=0.022mol,
故答案为:0.022.
点评 本题考查结构位置性质关系,为高考常见题型,侧重离子半径的大小比较、元素周期律、热化学方程式书写、离子浓度大小比较、化学图象及化学计算,是对学生综合能力的考查,需要学生具备扎实的基础,难度中等.

| A. | 钾、钠、镁等活泼金属着火时,不能用泡沫灭火器灭火 | |
| B. | 探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏低 | |
| C. | 滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小 | |
| D. | 为准确配制一定物质的量浓度的溶液,定容过程中向容量瓶内加蒸馏水至接近刻度线时,改用滴管滴加蒸馏水至刻度线 |
| 实验序号 | I | II | III | IV | Ⅴ |
| 样品质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.91 | 11.82 | 17.73 | 23.64 | 23.64 |
(1)样品中KHCO3和Na2CO3 的物质的量之比2:1.
(2)室温下第III组实验所得溶液中的 OH-物质的量浓度为0.6mol/L.
| 实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
(2)t1> t2(填“>”、“<”、“=”),其理由是①②两组温度相同,①中H2C2O4溶液浓度小于②
(3)实验②和实验③两组实验的目的是探究浓度不变时,温度对化学反应速率影响
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快.针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.
猜想②:Mn2+对该化学反应起催化作用(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是B.
A.硫酸钾B.硫酸锰C.水 D.氯化锰.
| A. | 酸 | B. | 非金属氧化物 | C. | 碱 | D. | 混合物 |
| A. | Na2S的电子式: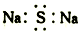 | B. | 二氧化硅的分子式:SiO2 | ||
| C. | 18O的原子结构示意图: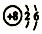 | D. | HClO分子的结构式:H-Cl-O |