题目内容
18.汽车尾气中所含污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还主要含有( )| A. | 氮气 | B. | 硫化氢 | C. | 氨气 | D. | 氮的氧化物 |
分析 高污染车排出的尾气中所含的污染物除碳氢化合物、可吸入颗粒物、一氧化碳外,还有车辆发动时氮气与氧气反应生成的氮的氧化物,氮的氧化物为空气污染物,以此来解答.
解答 解:A.氮气是空气的组成成分之一,不是污染物,不会引起污染,故A错误;
B.汽车尾气为高温条件下的产物,硫化氢和氧气在高温下反应生成二氧化硫和水,所以尾气中不可能含有硫化氢,故B错误;
C.放电以及高温下不可能生成氨气,应生成氮的氧化物,氨气不存在于汽车尾气中,故C错误;
D.车辆发动时氮气与氧气反应生成的氮的氧化物,氮的氧化物为空气污染物,故D正确.
故选D.
点评 本题是考查空气污染原因和污染物的种类,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生良好的科学素养,题目比较简单,主要考查了汽车尾气的成分,我们要从源头上控制破坏环境的行为,树立环境保护的意识.

练习册系列答案
相关题目
9.短周期元素W,X,Y,Z的原子序数依次增加,由以上四种元素组成的一种化合物m在400℃完全分解,其反应式为3m$\frac{\underline{\;400℃\;}}{\;}$4n+p+3q+6r,n能使湿润的红色石蕊试纸变蓝,q能用品红试液检验,下列说法正确的是( )
| A. | 原子半径:W<X<Y<Z | |
| B. | 简单氢化物的稳定性X>Y>Z | |
| C. | W、X、Y形成的化合物抑制水的电离 | |
| D. | m的分解产物中p为氧化产物,q为还原产物 |
6.用沉淀法测定 KHCO3和 Na2CO3 固体混合物的组成,每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的 Ba(OH)2 溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见表:
回答下列问题:
(1)样品中KHCO3和Na2CO3 的物质的量之比2:1.
(2)室温下第III组实验所得溶液中的 OH-物质的量浓度为0.6mol/L.
| 实验序号 | I | II | III | IV | Ⅴ |
| 样品质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.91 | 11.82 | 17.73 | 23.64 | 23.64 |
(1)样品中KHCO3和Na2CO3 的物质的量之比2:1.
(2)室温下第III组实验所得溶液中的 OH-物质的量浓度为0.6mol/L.
13.pH=3的盐酸和pH=11的氨水等体积混合,溶液中离子浓度关系正确的是( )
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
3.某实验小组利用硫酸酸化的KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”.该小组实验方案如表(实验测定KMnO4溶液完全褪色时间).回答下列问题:
(1)上述反应的离子方程式为2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O
(2)t1> t2(填“>”、“<”、“=”),其理由是①②两组温度相同,①中H2C2O4溶液浓度小于②
(3)实验②和实验③两组实验的目的是探究浓度不变时,温度对化学反应速率影响
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快.针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.
猜想②:Mn2+对该化学反应起催化作用(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是B.
A.硫酸钾B.硫酸锰C.水 D.氯化锰.
| 实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液完全褪色时间(s) | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | 2.0 | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 50 | t3 |
(2)t1> t2(填“>”、“<”、“=”),其理由是①②两组温度相同,①中H2C2O4溶液浓度小于②
(3)实验②和实验③两组实验的目的是探究浓度不变时,温度对化学反应速率影响
(4)有同学做实验时发现,硫酸酸化的KMnO4与H2C2O4反应开始时,溶液褪色慢,但反应一段时间后溶液褪色明显加快.针对上述实验现象,该同学提出下列猜想:
猜想①:硫酸酸化的KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快.
猜想②:Mn2+对该化学反应起催化作用(请你补充)
要证实猜想②,除硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择的试剂是B.
A.硫酸钾B.硫酸锰C.水 D.氯化锰.
7.在2NO2?N2O4的可逆反应中,下列状态一定属于平衡状态的是( )
| A. | N2O4和NO2的分子数比为1:2 | |
| B. | N2O4和NO2的浓度相等 | |
| C. | 体系的颜色不再改变 | |
| D. | 单位时间内有1molN2O4转化为NO2的同时,有2molNO2转化为N2O4 |
8.同温同压下,四个等体积的干燥圆底烧瓶中分别充满:①NH3 ②HCl(混有少量空气),③NO2,④NO2和O2(4:1)的混合气体,进行喷泉实验,经充分反应后,圆底瓶内溶液的物质的量浓度为(设溶质不扩散)( )
| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ①>②>③=④ |
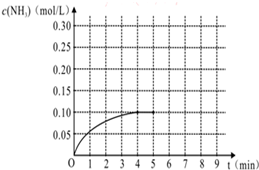 在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图:
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图: