��Ŀ����
12��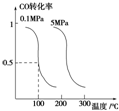 �о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ����˫Ӯ�Ŀ��⣮
�о��Ϳ���CO2��CO�Ĵ��������ǻ�����������Դ����˫Ӯ�Ŀ��⣮CO�����ںϳɼ״�����ѹǿΪ0.1MPa�����£������Ϊb L���ܱ������г���a mol CO��2a mol H2���ڴ��������ºϳɼ״���CO��g��+2H2��g���TCH3OH��g��
ƽ��ʱCO��ת�������¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��
��1���÷�Ӧ���ڷ��ȷ�Ӧ������ȡ����ȡ�����
��2��100��ʱ���÷�Ӧ��ƽ�ⳣ����K=$\frac{{b}^{2}}{{a}^{2}}$���ú�a��b�Ĵ���ʽ��ʾ������һ�����淴Ӧ��ƽ�ⳣ��Kֵ�ܴԴ˷�Ӧ��˵����ȷ����c������ţ���
a���÷�Ӧʹ�ô������岻��
b���÷�Ӧ�������ںܶ�ʱ�������
c���÷�Ӧ�ﵽƽ��ʱ������һ�ַ�Ӧ��ٷֺ�����С
d���÷�Ӧһ���Ƿ��ȷ�Ӧ
��3�����ݻ��̶��������н��з�ӦCO��g��+2H2��g���TCH3OH��g����������Щ����ܹ�˵����Ӧ�ﵽƽ��ad
a����������ѹǿ����
b��v����CO��=v����CH3OH��
c�����������ܶȱ��ֲ���
d����������ƽ����Է����������ٱ仯
��4�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���a mol CO��2a mol H2���ﵽƽ��ʱCOת������������������䡱��С������ͬ����ƽ�ⳣ�����䣮
��5����ij�¶��£���һ�ݻ�������ܱ������г���2.5mol CO��7.5mol H2����Ӧ����CH3OH��g�����ﵽƽ��ʱ��COת����Ϊ90%����ʱ������ѹǿΪ��ʼʱѹǿ��0.55����
��6��Ϊ��߸÷�ӦCO��ת���ʣ����Բ�ȡ��Щ��ʩ������д���㣩ͨ������H2��������ϵ��ѹǿ��
���� ��1����ͼ��֪��ѹǿһ��ʱ�����¶����ߣ�CO��ת���ʽ��ͣ��������¶�ƽ�����淴Ӧ�ƶ����ݴ��жϣ�
��2����ѧƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO��{c}^{2}��{H}_{2}��}$������CO��ת���ʣ���������ʽ�����ƽ��ʱ����ֵ����ʵ������������ƽ��ʱ����ֵ�Ũ�ȣ�����ƽ�ⳣ�����㣻
���淴Ӧ��ƽ�ⳣ��Խ��˵����Ӧ���еij̶�Խ����˵����Ӧ���ʿ���������˵���÷�Ӧ��ͨ��������һ�����Է���������˵����Ӧ�����Ȼ��Ƿ��ȣ�
��3����ƽ��״̬ʱ���淴Ӧ������ȣ�����ֵ�Ũ�ȱ��ֲ����״̬���ɴ˷����жϣ�
��4�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���a mol CO��g����2a mol H2��g������ЧΪ��ԭƽ��Ļ���������һ��ѹǿ��ƽ��������Ӧ�ƶ���
��ѧƽ�ⳣ��ֻ���¶�Ӱ�죬��Ũ���أ��¶Ȳ��䣬ƽ�ⳣ�����䣻
��5������μӷ�Ӧ��CO�����ʵ��������ò���������ƽ��ʱ��Ӧ���������ʵ����仯������������ƽ��ʱ�ܵ����ʵ��������ú��º����£�ѹǿ֮�ȵ������ʵ���֮�Ƚ��
��6����ӦCO��g��+2H2��g���TCH3OH��g���Ƿ��ȷ�Ӧ������Ӧ������������ٵķ�Ӧ�����Կ���ͨ��ͨ������H2��������ϵ��ѹǿ������߸÷�ӦCO��ת���ʣ�
��� �⣺��1����ͼ��֪��ѹǿһ��ʱ�����¶����ߣ�CO��ת���ʽ��ͣ��������¶�ƽ�����淴Ӧ�ƶ���������ӦΪ���ȷ�Ӧ��
�ʴ�Ϊ�����ȣ�
��2��100�棬ƽ��ʱCO��ת����Ϊ0.5�����Բμӷ�Ӧ��CO�����ʵ���Ϊ0.5amol��
CO��g��+2H2��g��?CH3OH��g����
��ʼ��mol����a 2a 0
�仯��mol����0.5a a 0.5a
ƽ�⣨mol����0.5a a 0.5a
����ƽ��ʱ��CO��Ũ��Ϊ$\frac{0.5amol}{bL}$=$\frac{a}{2b}$mol/L��H2��Ũ��Ϊ$\frac{a}{b}$=mol/L��CH3OH��Ũ��Ϊ$\frac{0.5amol}{bL}$=$\frac{a}{2b}$mol/L��100��ʱ�÷�Ӧ��ƽ�ⳣ��k�T$\frac{\frac{a}{2b}}{\frac{a}{2b}��\frac{a}{b}��^{2}}$=$\frac{{b}^{2}}{{a}^{2}}$��
a�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���÷�Ӧ��ͨ��������һ�����Է������÷�Ӧ������Ҫ�����ſ��Խ��У���a����
b�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���������·�Ӧ���ʺܿ죬��b����
c�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ�Ӧ��ƽ��ʱ������һ�ַ�Ӧ��İٷֺ�����С����c��ȷ��
d�����淴Ӧ��ƽ�ⳣ���ܴ�˵����Ӧ���еij̶Ⱥܴ���˵���÷�Ӧ�����Ȼ��Ƿ��ȣ���d����
�ʴ�Ϊ��$\frac{{b}^{2}}{{a}^{2}}$��c��
��3��a����������ѹǿ���䣬˵����������ʵ������䷴Ӧ��ƽ��״̬������ȷ��
b��v����CO��=v����CH3OH��������ӳ������Ӧ����δ����������Ĺ�ϵ���ʴ���
c�����������ܶ�һֱ���ֲ��䣬�ʴ���
d����������ƽ����Է����������ٱ仯����������ʵ������䣬��ƽ��״̬������ȷ��
��ѡ��ad��
��4�����¶Ⱥ��ݻ����������£�����ƽ����ϵ�г���a mol CO��g����2a mol H2��g������ЧΪ��ԭƽ��Ļ���������һ��ѹǿ��ƽ��������Ӧ�ƶ���CO��ת��������ѧƽ�ⳣ��ֻ���¶�Ӱ�죬��Ũ���أ��¶Ȳ��䣬ƽ�ⳣ�����䣬
�ʴ�Ϊ�������䣻
��5���μӷ�Ӧ��CO�����ʵ���Ϊ2.5mol��90%=2.25mol����
CO��g��+2H2��g��?CH3OH��g�� ���ʵ������١�n
1 2
2.25mol 4.5mol
��ƽ��ʱ�ܵ����ʵ���Ϊ2.5mol+7.5mol-4.5mol=5.5mol�����º�����ѹǿ֮�ȵ������ʵ���֮�ȣ���ƽ��ʱ������ѹǿΪ��ʼʱѹǿ�� $\frac{5.5mol}{2.5mol+7.5mol}$=0.55�����ʴ�Ϊ��0.55��
��6����ӦCO��g��+2H2��g���TCH3OH��g���Ƿ��ȷ�Ӧ������Ӧ������������ٵķ�Ӧ�����Կ���ͨ��ͨ������H2��������ϵ��ѹǿ������߸÷�ӦCO��ת���ʣ��ʴ�Ϊ��ͨ������H2��������ϵ��ѹǿ��
���� ���⿼��ƽ�ⳣ������ѧƽ����㡢��ѧƽ���Ӱ�����ؼ���ͼ�����ȣ��ۺ��Խϴ��Ѷ��еȣ�Ӧ��ǿƽʱ֪ʶ�Ļ��ۣ�ע�����ö�һ���ԭ�����ͼ��

 �п������п��Ծ����ϵ�д�
�п������п��Ծ����ϵ�д� ��������״Ԫ��ϵ�д�
��������״Ԫ��ϵ�д� �ƸԿ�����ҵ��ϵ�д�
�ƸԿ�����ҵ��ϵ�д�| A�� | ������Ϊ0.1NA ��N2 ��NH3 ������壬ԭ�Ӽ京�еĹ��õ��Ӷ���ĿΪ0.3NA | |
| B�� | 2 mol SO2 ��1 mol O2 ��һ�������³�ַ�Ӧ�����û������ķ���������2NA | |
| C�� | 1.5 mol NO2 ������ˮ��Ӧ��ת�Ƶĵ�����Ϊ1.5NA | |
| D�� | ���������£�������ΪNA ��CO��N2�����������Ϊ28 g |
| A�� | Na202������H20��Ӧ���ɱ����11.2L 02��ת�Ƶ��ӵ���ĿΪ2NA | |
| B�� | ��״���£�2.24L S03������������Ϊ4NA | |
| C�� | �ö��Ե缫���CuS04��Һ���������0.1mol Cu��0H��2��ʹ��Һ��ԭ�����·��ת�Ƶ��ӵ���ĿΪ0.2NA | |
| D�� | 0���101kp�������£�1.12L������ȫȼ�����ɵ�ˮ������Ϊ0.1NA |
| A�� | 3.0g��ȩ�ͼ�������Ļ�����к��е�ԭ����Ϊ4NA | |
| B�� | �ȼҵ�У�������������״���µ�����22.4Lʱ����·��ת�Ƶĵ�����Ϊ2NA | |
| C�� | ��״���£�0.1mol���к��еĦҼ�����ĿΪ0.6NA | |
| D�� | ����200ml0.1mol/L��ϡ���ᣬ��Ҫ98%��Ũ����0.02NA |
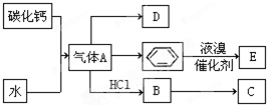
 ��D�����ʽCH2=CH2��
��D�����ʽCH2=CH2�� +Br2 $\stackrel{FeBr_{3}}{��}$
+Br2 $\stackrel{FeBr_{3}}{��}$ +HBr���䷴Ӧ����Ϊȡ����Ӧ��B��C�Ļ�ѧ����ʽnCH2=CHCl$\stackrel{����}{��}$
+HBr���䷴Ӧ����Ϊȡ����Ӧ��B��C�Ļ�ѧ����ʽnCH2=CHCl$\stackrel{����}{��}$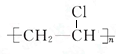 ���䷴Ӧ����Ϊ�Ӿ۷�Ӧ��
���䷴Ӧ����Ϊ�Ӿ۷�Ӧ��
 ���������ַ��������Ƶð�ɫ��Fe��OH��2������
���������ַ��������Ƶð�ɫ��Fe��OH��2������
 ��B��ͬ���ڵ�һ��������С��Ԫ�أ�C��������������ɵ����ӣ�E����Χ�����Ų�ʽΪ3d64s2���ش��������⣺
��B��ͬ���ڵ�һ��������С��Ԫ�أ�C��������������ɵ����ӣ�E����Χ�����Ų�ʽΪ3d64s2���ش��������⣺