题目内容
1.设NA为阿伏加德罗常数的值,下列说法一定错误的是( )| A. | 分子数为0.1NA 的N2 和NH3 混合气体,原子间含有的共用电子对数目为0.3NA | |
| B. | 2 mol SO2 和1 mol O2 在一定条件下充分反应后,所得混合气体的分子数大于2NA | |
| C. | 1.5 mol NO2 与足量水反应,转移的电子数为1.5NA | |
| D. | 常温条件下,分子数为NA 的CO、N2混合气体质量为28 g |
分析 A、氮气中含3对共用电子对,氨气中也含3对共用电子对;
B、二氧化硫和氧气的反应为可逆反应,不能进行彻底;
C、NO2和水的反应中:3NO2+H2O?2HNO3+NO,3molNO2转移2mol电子;
D、CO和氮气的摩尔质量均为28g/mol.
解答 解:A、氮气中含3对共用电子对,氨气中也含3对共用电子对,故0.1NA个N2 和NH3混合气体中含0.3NA对共用电子对,故A正确;
B、二氧化硫和氧气的反应为可逆反应,不能进行彻底,故所得的混合气体中分子个数大于2NA个,故B正确;
C、NO2和水的反应中:3NO2+H2O?2HNO3+NO,3molNO2转移2mol电子,1.5 mol NO2 与足量水反应,转移的电子数为NA,故C错误;
D、CO和氮气的摩尔质量均为28g/mol,故NA个混合气体的分子的质量为28g,故D正确.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
12.黑火药在适当的外界能量作用下,能进行迅速而有规律的燃烧,瞬间产生大量的热和氮气、二氧化碳等气体,由干体积急剧膨胀,压力猛烈增大,于是发生了爆炸.反应方程式为S+2KNO3+3C=K2S+N2↑+3CO2↑,下列说法错误的是( )
| A. | C在反应中被还原 | B. | S和KNO3都发生了还原反应 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |
13.下列鉴别物质的方法能达到目的是( )
| A. | 用Ba(N03)2溶液鉴别CaCl2溶液和(NH4)2SO4溶液 | |
| B. | 用稀硫酸鉴别碳酸钠固体和碳酸钾固体 | |
| C. | 用湿润的蓝色石蕊试纸鉴别氨气和氢气 | |
| D. | 用淀汾溶液鉴别加碘盐(含KI03)和未加碘盐 |
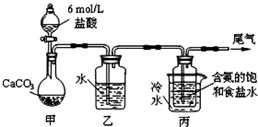 碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.
碳酸钠俗称纯碱,在日常生产和生活中有着广泛的应用.某化学兴趣小组想根据所学知识模拟制备碳酸钠,方法如下:先以NaCl、NH3、CO2和水等为原料以及如图所示装置制取NaHCO3(反应的化学方程式为NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再将NaHCO3制成Na2CO3.
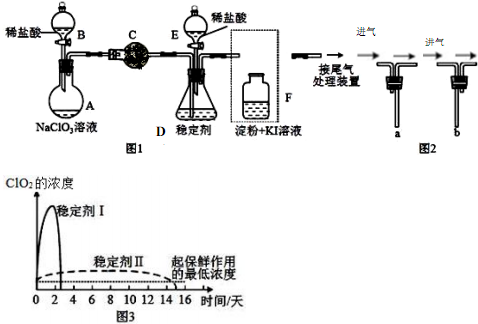
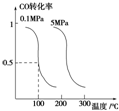 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.