题目内容
4.科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的明确性.(一)学生(甲)应用下图装置(A)所示意的方法研究氯气的性质,其中气体的主要成分是氯气(含有空气和水蒸气).请回答下列问题:

(1)该项研究(实验)的主要目的是比较干燥的氯气和潮湿的氯气的漂白性(或研究氯气的漂白性实验等合理答案均可)
(2)浓硫酸的作用是吸收气体中的水.与研究目的直接相关的实验现象是干燥的有色布条不褪色,湿润的有色布条褪色.
(3)虚框中的装置应选择B (填“B”或“C”),其盛放的试剂为NaOH溶液 (填试剂名称);使用该装置的目的是防止有毒的Cl2污染空气;该装置内发生反应的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
(二)学生(乙)设计实验探究金属铝表面氧化膜的性质:将铝片(含氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质.若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化.回答下列问题:
(1)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是2Al+3Cu2+=3Cu+2Al3+.
(2)同学(乙)认为:铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因是“氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能”.并设计如下实验方案进行验证,请你根据其思路完成下列空格:
[实验方案]在硫酸铜溶液中加入铝片,无明显现象,再加入氯化钠(填试剂名称)溶液,再观察现象.若反应明显加快了,说明上述推断正确.
分析 (一)由实验装置可知,氯气干燥后,干燥布条不褪色,湿润的布条褪色,虚框中的装置利用碱吸收尾气;
(1)混有水蒸汽的氯气,先通过浓硫酸,得到干燥的氯气;氯气分别与干燥、湿润的有色面条接触,很明显是对比实验,比较干燥的、潮湿的氯气的漂白性差异;
(2)浓硫酸吸收气体中的水,必然导致干燥的有色面条无变化,但与湿润的有色布条可生成次氯酸,最终导致其褪色;
(3)由于氯气有毒,不能直接排放到空气中,而C装置是个密封装置,应选择B装置碱液吸收;
(二)设计实验探究金属铝表面氧化膜的性质,氧化铝与氯化铜、硫酸铜不反应,短时间内铝片无明显变化,水解生成的氢离子先除去氧化膜,再发生Al与盐溶液反应,
(1)红色物质为铝置换出的铜单质;
(2)实验中两盐溶液溶质的差别无所谓就是阴离子的不同,导致了反应现象的不同,故可在硫酸铜溶液中加入铝片,无明显现象后,再加入含有氯离子溶液即可,为了不改变溶液的酸碱性,最好加入氯化钠溶液.
解答 解:(一)(1)混有水蒸汽的氯气,先通过浓硫酸,得到干燥的氯气;随后氯气分别与干燥、湿润的有色面条接触,很明显是对比实验,比较干燥的、潮湿的氯气的漂白性差异,
故答案为:比较干燥的氯气和潮湿的氯气的漂白性(或研究氯气的漂白性实验等合理答案均可);
(2)浓硫酸吸收气体中的水,必然导致干燥的有色面条无变化,但与湿润的有色布条可生成次氯酸,最终导致其褪色,与研究目的直接相关的实验现象是干燥的有色布条不褪色,湿润的有色布条褪色,
故答案为:吸收气体中的水;干燥的有色布条不褪色,湿润的有色布条褪色;
(3)由于氯气有毒,不能直接排放到空气中,而C装置是个密封装置,不正确,故应选择B装置,氯气可被NaOH溶液吸收,发生2NaOH+Cl2═NaCl+NaClO+H2O,
故答案为:B;NaOH溶液;防止有毒的Cl2污染空气;2NaOH+Cl2═NaCl+NaClO+H2O;
(二)设计实验探究金属铝表面氧化膜的性质,氧化铝与氯化铜、硫酸铜不反应,短时间内铝片无明显变化,水解生成的氢离子先除去氧化膜,再发生Al与盐溶液反应,(1)红色物质为铝置换出的铜单质,发生离子反应为2Al+3Cu2+=3Cu+2Al3+,故答案为:2Al+3Cu2+=3Cu+2Al3+;
(2)实验中两盐溶液溶质的差别无所谓就是阴离子的不同,导致了反应现象的不同,故可在硫酸铜溶液中加入铝片,无明显现象后,再加入含有氯离子溶液即可,为了不改变溶液的酸碱性,在硫酸铜溶液中加入铝片,无明显现象,再加入氯化钠溶液,若反应明显加快了,说明上述推断正确,
故答案为:氯化钠.
点评 本题考查性质实验方案的设计,为高频考点,注意通过实验设计与探究来研究反应原理及物质的性质,侧重分析与实验能力的考查,题目难度中等.

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案| A. | C在反应中被还原 | B. | S和KNO3都发生了还原反应 | ||
| C. | CO2是反应的氧化产物 | D. | K2S和N2都是反应的还原产物 |
| A. | 用Ba(N03)2溶液鉴别CaCl2溶液和(NH4)2SO4溶液 | |
| B. | 用稀硫酸鉴别碳酸钠固体和碳酸钾固体 | |
| C. | 用湿润的蓝色石蕊试纸鉴别氨气和氢气 | |
| D. | 用淀汾溶液鉴别加碘盐(含KI03)和未加碘盐 |
| A. | 充电过程是化学能转化为电能的过程 | |
| B. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O | |
| C. | 放电时负极附近溶液的酸性增强 | |
| D. | 放电时电解质溶液中的OH-向正极移动 |
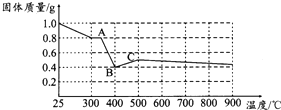 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:全部是Fe3O4
假设三:是FeO和Fe3O4的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成下表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立 |
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.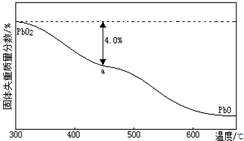 (1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O.PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为PbO+ClO-=PbO2+Cl-.
(1)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为PbO2+4HCl(浓)=PbCl2+Cl2↑+2H2O.PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为PbO+ClO-=PbO2+Cl-. .
.