题目内容
17.有反应:m A(s)+n B(g)?p C(g)达到平衡后,当升高温度时,B的转化率变大; 当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的逆反应为放热反应,且n>p(填“>”、“=”或“<”)
(2)若等温等积时加入B,则B的转化率增大.(填“增大”、“减小”或“不变”,下同)
(3)若加入催化剂,平衡时气体混合物的总物质的量不变;加入少量A,则C的浓度不变.
(4)若B是有色物质,A、C均无色,平衡后,维持容器内压强不变,充入氖气,混合物颜色变浅;(填“变深”、“变浅”或“不变”) 而恒温等容时,在平衡体系中加入C时则混合物颜色变深.
(5)缩小体积使体系压强由原平衡的P0变为2P0,则新平衡时体系压强P的范围是P0<P<2P0.
分析 (1)当升高温度时,B的转化率变大,平衡正向移动,说明正反应是吸热反应,当减小压强时,混合体系中C的质量分数减小,平衡逆向移动,则逆反应是气体体积增大的反应;
(2)若等温等积时加入B,相当增大压强,平衡正向移动;
(3)若加入催化剂,平衡不移动,平衡时气体混合物的总物质的量不变,加入少量A,A是固体物质,浓度不变,平衡不移动,则C的浓度不变;
(4)若B是有色物质,A、C均无色,而维持容器内压强不变,充入氖气时,体积增大,对于反应体系来说,相当于减小压强,则平衡向逆反应方向移动,则B的浓度增大,颜色变深,但体积变化占主导,所以颜色变浅,则恒容下加入C,平衡向逆反应方向移动,但B的浓度增大,则颜色变深;
(5)根据平衡移动的原理分析解答.
解答 解:(1)当升高温度时,B的转化率变大,平衡正向移动,说明正反应是吸热反应,所以逆反应放热,当减小压强时,混合体系中C的质量分数减小,平衡逆向移动,则逆反应是气体体积增大的反应,则n>p,故答案为:放;>;
(2)若等温等积时加入B,相当增大压强,平衡正向移动,则是B的转化率增大,故答案为:增大;
(3)若加入催化剂,平衡不移动,平衡时气体混合物的总物质的量不变,加入少量A,A是固体物质,浓度不变,平衡不移动,则C的浓度不变,故答案为:不变;不变;
(4)若B是有色物质,A、C均无色,而维持容器内压强不变,充入氖气时,体积增大,对于反应体系来说,相当于减小压强,则平衡向逆反应方向移动,则B的浓度增大,颜色变深,但体积变化占主导,所以颜色变浅,则恒容下加入C,平衡向逆反应方向移动,但B的浓度增大,则颜色变深,
故答案为:变浅;变深;
(5)缩小体积使体系压强由原平衡的P0变为2P0,平衡移动的结果使压强减少,但不抵消,所以压强为:P0<P<2P0,故答案为:P0<P<2P0.
点评 本题考查外界条件对平衡移动的影响,题目难度不大,注意分析反应的特征为解答该题的关键.

 阅读快车系列答案
阅读快车系列答案| A. | 澄清的石灰水与稀盐酸反应Ca(OH)2+2H+═Ca2++2H2O | |
| B. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 氧化铜溶于硫酸:O2-+2H+═H2O | |
| D. | 碳酸钙溶于醋酸CaCO3+2CH3COOH═Ca2++2CH3COO-+H2O+CO2↑ |
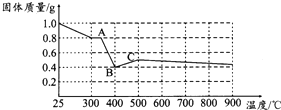 草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.
草酸亚铁晶体(FeC2O4•2H2O)呈淡黄色.某课题组为探究草酸业铁晶体的化学性质,进行了一系列实验探究.(1)向盛有草酸亚铁晶体的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,并检测到二氧化碳气体生成.这说明草酸亚铁晶体具有还原性(填“氧化性”、“还原性”或“碱性”).若反应中消耗1mol FeC2O4•2H2O,则参加反应的KMnO4为0.6mol.
(2)资料表明:在密闭容器中加热到一定温度时,草酸亚铁晶体可完全分解,生成几种氧化物,残留物为黑色固体.课题组根据课本上所介绍的铁的氧化物的性质,对黑色固体的组成提出如下假设,请你完成假设二和假设三:
假设一:全部是FeO
假设二:全部是Fe3O4
假设三:是FeO和Fe3O4的混合物
(3)为验证上述假设一是否成立,课题组进行如下研究.
【定性研究】请你完成下表中内容.
| 实验步骤(不要求写出具体操作过程) | 预期实验现象和结论 |
| 取少量黑色固体,加入适量稀盐酸(或稀硫酸)溶解,在溶液中加入KSCN溶液 | 若溶液不变红色,则假设一成立;若溶液变红色,则假设一不成立 |
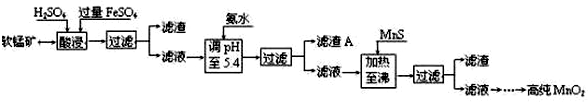
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物.部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
(2)滤渣A的主要成分是Fe(OH)3和Al(OH)3.
(3)加入MnS的目的是除去Cu2+、Zn2+杂质.
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为MnO2+H2O+e-=MnOOH+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-).
(5)从废旧碱性锌锰电池中可以回收利用的物质有锌、二氧化锰(写两种).
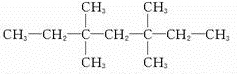
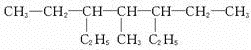
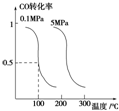 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.