题目内容
18.等物质的量的CO和CO2,二者的质量之比7:11,在同温同压下的体积之比1:1,氧原子数之比1:2,摩尔质量之比7:11.分析 根据N=nNA,以及n=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$,结合分子的构成进行计算.
解答 解:根据m=nM,二者的质量之比为:m(CO):m(CO2)=nM(CO):nM(CO2)=28:44=7:11,由n=$\frac{v}{{v}_{m}}$可知,等物质的量的CO和CO2,二者体积比为1:1,根据N=nNA可知,分子数之比等于物质的量之比,而1个CO分子中含有1个C原子,1个O原子,1个CO2分子中含有1个C原子,2个O原子,所以:等物质的量的CO和CO2中所含氧原子个数之比1:2,摩尔质量之比等于相对分子量之比,即M(CO):M(CO2)=28:44=7:11,
故答案为:7:11;1:1;1:2;7:11.
点评 本题考查物质的量的计算,比较基础,注意对阿伏伽德罗定律及其推论的理解掌握,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
13.25℃、101kPa下:①2Na(s)+$\frac{1}{2}$O2(g)=Na2O(s) 放出414kJ的热量
②2Na(s)+O2(g)=Na2O2(s) 放出511kJ的热量
下列说法正确的是( )
②2Na(s)+O2(g)=Na2O2(s) 放出511kJ的热量
下列说法正确的是( )
| A. | ①和②产物含有阴阳离子个数比不相等 | |
| B. | ①和②生成等物质的量的产物,转移电子数不同 | |
| C. | 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率越来越快 | |
| D. | 25℃.101kPa下:Na2O2(s)+2Na(s)═2Na2O(S) 放出317kJ的热量 |
7.下列说法不正确的是( )
| A. | 利用地沟油制肥皂的实验中,可以用玻璃棒蘸取反应液滴入有热水的试管中,振荡,若无油滴浮在液面上,说明反应液中的地沟油已完全皂化 | |
| B. | 制备硝基苯,混合药品的先后顺序为:向试管中先加入苯,再加入浓硫酸,最后加入浓硝酸 | |
| C. | 除去溴乙烷中的少量溴:加入Na2SO3溶液,振荡,静置分层后,除去水层 | |
| D. | 实验室受酸腐蚀时的处理:先用大量水冲洗,再用饱和碳酸氢钠溶液或肥皂水洗,最后再用水冲洗 |
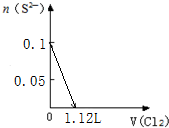
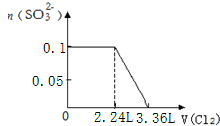
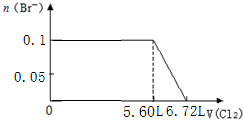
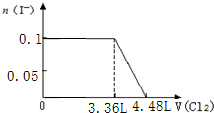
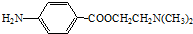 )可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):
)可用作临床麻醉剂,熔点约60℃.它的一条合成路线如下图所示(部分反应试剂和条件已省略):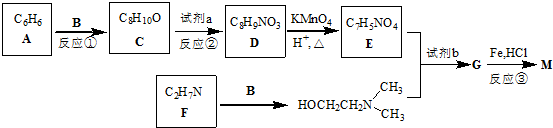
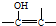 的结构不稳定.
的结构不稳定.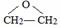 FH3C-NH-CH3
FH3C-NH-CH3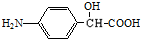 .
. .
.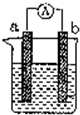 如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: