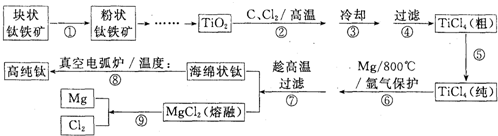
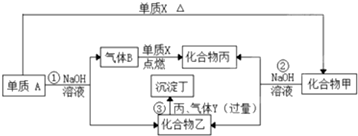
题目内容
常温下将pH=2的盐酸和pH=11的氢氧化钠溶液,以体积比1:9混合后,溶液的pH是( )
| A、3 | B、4 | C、9 | D、10 |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:常温下pH=2的盐酸中c(H+)=10-2mol/L,pH=11的氢氧化钠中c(OH-)=
mol/L=10-3mol/L,二者以体积比1:9混合,则盐酸过量,溶液呈酸性,先计算混合溶液中氢离子浓度,再计算混合液的pH.
| 10-14 |
| 10-11 |
解答:
解:在常温下,pH=2的盐酸中氢离子浓度为:c(H+)=0.01mol/L,
pH=11的氢氧化钠中氢氧根离子浓度为:c(OH-)=
mol/L=0.001mol/L,
两溶液以体积比1:9混合,盐酸过量,溶液呈酸性,
混合溶液中氢离子浓度为:c(H+)=
mol/L=10-4mol/L,
则混合液的pH=-lgc(H+)=-lg10-4=4,
故选B.
pH=11的氢氧化钠中氢氧根离子浓度为:c(OH-)=
| 10-14 |
| 10-11 |
两溶液以体积比1:9混合,盐酸过量,溶液呈酸性,
混合溶液中氢离子浓度为:c(H+)=
| 0.01×1-0.001×9 |
| 1+9 |
则混合液的pH=-lgc(H+)=-lg10-4=4,
故选B.
点评:本题考查了混合液pH的简单计算,题目难度不大,注意掌握溶液酸碱性与溶液pH的关系,明确酸碱混合液的pH的计算方法,若混合液为酸性,可直接计算出混合液中氢离子浓度,若混合液为碱性溶液,则应该先计算出混合液中氢氧根离子浓度,然后再根据水的离子积计算出氢离子浓度.

练习册系列答案
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案
相关题目
如图是关于N2+3H2?2NH3△H<0的速率-时间图象,则t1时刻使平衡发生移动的原因是( )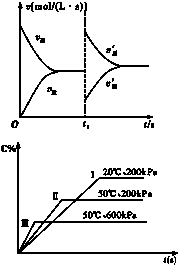

| A、升高温度,同时增大压强 |
| B、降低温度,同时减小压强 |
| C、增大反应物的浓度,同时使用适宜的催化剂 |
| D、增大反应物的浓度,同时减小生成物的浓度 |
 已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)?C(g)△H<0.达到平衡时,C的体积分数为40%.试回答有关问题:
已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)?C(g)△H<0.达到平衡时,C的体积分数为40%.试回答有关问题: