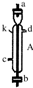题目内容
 已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)?C(g)△H<0.达到平衡时,C的体积分数为40%.试回答有关问题:
已知一定温度和压强下,在容积为VL的密闭容器中充入1molA和1molB,保持恒温恒压下反应:A(g)+B(g)?C(g)△H<0.达到平衡时,C的体积分数为40%.试回答有关问题:(1)升温时,C的反应速率
(2)若平衡时,保持容器容积不变,使容器内压强增大,则平衡
A.一定向正反应方向移动 B.一定向逆反应方向移动
C.一定不移动 D.不一定移动
(3)若使温度、压强在上述条件下恒定不变,在密闭容器中充入2molA和2molB,则反应达到平衡时,C的体积分数为
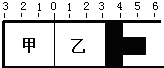
(4)如图所示,容器被分隔成甲乙两部分,温度保持不变,甲容积固定不变,乙有可移动的活塞.现在甲中充入1molA和1molB,在乙中充入1mol C和1molN2,在相同条件下发生可逆反应:A(g)+B(g)?C(g)固定活塞位置在3处不动,达到平衡时,设甲中压强为p(甲),乙中压强为p(乙),则p(甲)与p(乙)的关系为
考点:化学平衡的计算,化学平衡建立的过程,化学反应速率的影响因素
专题:化学平衡专题
分析:(1)升高温度,活化分子数目增大,反应速率加快;
(2)保持容器容积不变,使容器内压强增大,可能是改变反应混合物的浓度,也可能是加入其它不反应的气体引起压强的增大;
(3)恒温恒压下,两平衡A与B的起始物质的量之比都为1:1,两平衡是等效平衡,到达平衡是C的体积分数相同;
计算平衡时反应混合物的总的物质的量,利用同温同压下体积之比等于物质的量之比,计算容器的体积;
(4)根据左右两个容器压强相等,从等效平衡的角度分析;充入的氮气相当于增大体系压强,平衡不动;根据左右两个容器压强相等,从等效平衡的角度分析;
若活塞右移到5处,则乙中压强减小平衡逆向移动,C的物质的量减小.
(2)保持容器容积不变,使容器内压强增大,可能是改变反应混合物的浓度,也可能是加入其它不反应的气体引起压强的增大;
(3)恒温恒压下,两平衡A与B的起始物质的量之比都为1:1,两平衡是等效平衡,到达平衡是C的体积分数相同;
计算平衡时反应混合物的总的物质的量,利用同温同压下体积之比等于物质的量之比,计算容器的体积;
(4)根据左右两个容器压强相等,从等效平衡的角度分析;充入的氮气相当于增大体系压强,平衡不动;根据左右两个容器压强相等,从等效平衡的角度分析;
若活塞右移到5处,则乙中压强减小平衡逆向移动,C的物质的量减小.
解答:
解;(1)升高温度,活化分子数目增大,反应速率加快,故答案为:加快;
(2)保持容器容积不变,使容器内压强增大,可能是改变反应混合物的浓度,若只增大A或B的浓度,平衡向正反应移动,若只增大C的浓度,平衡向逆反应移动,若同等程度增大A、B、C的浓度,平衡向正反应移动;如果是加入其它不反应的气体引起压强的增大,反应混合物的浓度不发生变化,平衡不移动,故平衡平衡可能移动,可能不移动,
故选:D;
(3)恒温恒压下,两平衡A与B的起始物质的量之比都为1:1,两平衡是等效平衡,到达平衡是C的体积分数相同,故在密闭容器中充入2mol A和2molB,反应达到平衡时C的体积分数为40%;
令物质的量为a,则:
A(g)+B(g)?C(g)
开始(mol):2mol 2mol 0
变化(mol):a a a
平衡(mol):(2-a ) (2-a) a
故
×100%=40%,解得a=
mol
故平衡后反应混合物的总的物质的量为4mol-
mol=
mol,
同温同压下体积之比等于物质的量之比,所以容器的体积为VL×
=
VL.
故答案为:40%;
VL;
(4)容器被分隔成甲乙两部分,温度保持不变,甲容积固定不变,乙有可移动的活塞,甲中充入1molA和1molB,在乙中充入1mol C和1molN2,在相同条件下发生可逆反应:A(g)+B(g)?C(g)固定活塞位置在3处不动,达到平衡时,乙中相当于甲容器中的平衡状态中加入氮气,总压增大分压不变,平衡不动,设甲中压强为p(甲),乙中压强为p(乙),则p(甲)<p(乙);乙中C为xmol,甲中C为ymol,若活塞右移到5处,压强减小,平衡逆向进行,达到平衡后,乙中C物质的量减小,则x与y之间的关系x<y;
故答案为:<;<;若活塞右移到5处,压强减小,平衡逆向进行,达到平衡后,乙中C物质的量减小,则x与y之间的关系x<y.
(2)保持容器容积不变,使容器内压强增大,可能是改变反应混合物的浓度,若只增大A或B的浓度,平衡向正反应移动,若只增大C的浓度,平衡向逆反应移动,若同等程度增大A、B、C的浓度,平衡向正反应移动;如果是加入其它不反应的气体引起压强的增大,反应混合物的浓度不发生变化,平衡不移动,故平衡平衡可能移动,可能不移动,
故选:D;
(3)恒温恒压下,两平衡A与B的起始物质的量之比都为1:1,两平衡是等效平衡,到达平衡是C的体积分数相同,故在密闭容器中充入2mol A和2molB,反应达到平衡时C的体积分数为40%;
令物质的量为a,则:
A(g)+B(g)?C(g)
开始(mol):2mol 2mol 0
变化(mol):a a a
平衡(mol):(2-a ) (2-a) a
故
| a |
| 2-a+2-a+a |
| 8 |
| 7 |
故平衡后反应混合物的总的物质的量为4mol-
| 8 |
| 7 |
| 20 |
| 7 |
同温同压下体积之比等于物质的量之比,所以容器的体积为VL×
| ||
| 1mol+1mol |
| 10 |
| 7 |
故答案为:40%;
| 10 |
| 7 |
(4)容器被分隔成甲乙两部分,温度保持不变,甲容积固定不变,乙有可移动的活塞,甲中充入1molA和1molB,在乙中充入1mol C和1molN2,在相同条件下发生可逆反应:A(g)+B(g)?C(g)固定活塞位置在3处不动,达到平衡时,乙中相当于甲容器中的平衡状态中加入氮气,总压增大分压不变,平衡不动,设甲中压强为p(甲),乙中压强为p(乙),则p(甲)<p(乙);乙中C为xmol,甲中C为ymol,若活塞右移到5处,压强减小,平衡逆向进行,达到平衡后,乙中C物质的量减小,则x与y之间的关系x<y;
故答案为:<;<;若活塞右移到5处,压强减小,平衡逆向进行,达到平衡后,乙中C物质的量减小,则x与y之间的关系x<y.
点评:本题考查影响反应速率的因素、化学平衡的有关计算、等效平衡等,难度中等,注意对等效平衡的理解,掌握等效平衡规律.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生.(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测错误的是( )
| A、K+一定存在 |
| B、每份取样溶液中含0.02mol CO32- |
| C、Cl-可能存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
常温下将pH=2的盐酸和pH=11的氢氧化钠溶液,以体积比1:9混合后,溶液的pH是( )
| A、3 | B、4 | C、9 | D、10 |
已知PbI2的Ksp=7.0×10-9,若7.5×10-3mol?L-1的KI与某浓度的Pb(NO3)2溶液按2:1的体积比混合,则生成PbI2沉淀所需溶液Pb(NO3)2的最小浓度为( )
| A、2.8×10-6 mol?L-1 |
| B、4.2×10-6mol?L-1 |
| C、2.8×10-4 mol?L-1 |
| D、8.4×10-4 mol?L-1 |