题目内容
金属钛被誉为“21世纪金属”,有“生物金属,海洋金属,太空金属”等美称.高纯钛具有比强度(即强度与密度之比)大、良好的可塑性、耐腐蚀、耐高温、耐低温、记忆能力等优良性能,但当有杂质存在时,钛就变得脆而硬,其他性能也大打折扣.
我国盛产钛铁矿.由钛铁矿制备高纯钛的工艺流程如下图:
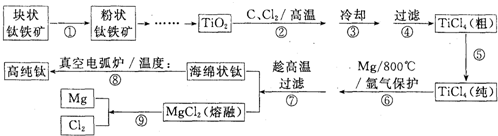
下表是上图中的部分物质的熔沸点:
请填写下列空白:
(1)需进行第①步操作的作用是 .
(2)第②步中反应的化学方程式是:TiO2+2C+2Cl2
TiCl4+2CO.该反应的氧化剂是 ,生成190kg TiCl4时转移电子的物质的量是 mol.
(3)第④步中的过滤与第⑦步中的过滤在设备的要求上有什么不同? .
(4)第⑤步提纯TiCl4的方法是 ,要得到纯净的TiCl4,必须在 ℃时收集.第⑧步的真空电弧炉中的温度接近 ℃.
(5)已知钛的还原性介于铝与锌之间.估计钛能耐腐蚀的原因之一是 .如果可从Na、Zn、Fe三种金属中选一种金属代替第⑥步中的镁,那么,该金属跟四氯化钛反应的化学方程式是 .
(6)⑥⑦⑨三步操作需在稀有气体保护下进行的原因是 .
我国盛产钛铁矿.由钛铁矿制备高纯钛的工艺流程如下图:

下表是上图中的部分物质的熔沸点:
| 物质 | Mg | Ti | MgCl2 | TiCl4 |
| 熔点/℃ | 648.8 | 1660 | 714 | -25 |
| 沸点/℃ | 1107 | 3287 | 1412 | 136.4 |
(1)需进行第①步操作的作用是
(2)第②步中反应的化学方程式是:TiO2+2C+2Cl2
| ||
(3)第④步中的过滤与第⑦步中的过滤在设备的要求上有什么不同?
(4)第⑤步提纯TiCl4的方法是
(5)已知钛的还原性介于铝与锌之间.估计钛能耐腐蚀的原因之一是
(6)⑥⑦⑨三步操作需在稀有气体保护下进行的原因是
考点:物质分离和提纯的方法和基本操作综合应用
专题:元素及其化合物
分析:(1)粉末状物质的反应速率要快于块状物质的反应速率;
(2)根据元素的化合价变化确定氧化剂以及电子转移情况;
(3)根据两步过滤:常温温度下的过滤和高温过滤来回答;
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,根据物质的沸点高低来回答;
(5)根据金属铝的氧化物的性质结合信息来回答,金属钠的活泼性强,可以用于金属的冶炼;
(6)Mg、Ti可以跟空气中O2、N2和CO2反应,据此回答.
(2)根据元素的化合价变化确定氧化剂以及电子转移情况;
(3)根据两步过滤:常温温度下的过滤和高温过滤来回答;
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,根据物质的沸点高低来回答;
(5)根据金属铝的氧化物的性质结合信息来回答,金属钠的活泼性强,可以用于金属的冶炼;
(6)Mg、Ti可以跟空气中O2、N2和CO2反应,据此回答.
解答:
解:(1)粉末状物质的反应速率要快于块状物质的反应速率,需进行第①步操作的作用是:增加反应物之间的接触面积,增大化学反应速率,提高生产效率,故答案为:增加反应物之间的接触面积,增大化学反应速率,提高生产效率;
(2)反应TiO2+2C+2Cl2
TiCl4+2CO中,氯气中Cl化合价降低,氯气是氧化剂,生成190gTiCl4时转移电子的物质的量是4mol,所以生成190gTiCl4时转移电子的物质的量是4×103mol,故答案为:Cl2;4×103;
(3)第④步中的过滤是常温温度下的过滤,第⑦步中的过滤是高温下的过滤,设备必须能耐800℃的高温,故答案为:设备必须能耐800℃的高温;
(4)根据图中的部分物质的熔沸点,应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,要得到纯净的TiCl4,必须在136.4℃时收集,因为TiCl4沸点是136.4℃,Ti的沸点是:1660℃,第⑧步的真空电弧炉中的温度接近 1660℃,故答案为:蒸馏;136.4℃;1660℃;
(5)钛的还原性介于铝与锌之间,氧化铝是一层致密的氧化膜,估计钛能耐腐蚀的原因钛表面形成一层致密的氧化膜(或钛的内部结构紧密);活泼金属钠可以将金属钛置换出来:TiCl4+4Na
Ti+4NaCl,Zn、和Fe都是不可以的,活泼性差,
故答案为:钛表面形成一层致密的氧化膜(或钛的内部结构紧密);TiCl4+4Na
Ti+4NaCl;
(6)Mg、Ti可以跟空气中O2、N2和CO2反应,防止生成的Mg、Ti的氧化物及氮化物导致制取的金属钛不纯,⑥⑦⑨三步操作需在稀有气体保护下进行,
故答案为:防止Mg、Ti跟空气中O2、N2和CO2反应生成Mg、Ti的氧化物及氮化物得不到高纯钛.
(2)反应TiO2+2C+2Cl2
| ||
(3)第④步中的过滤是常温温度下的过滤,第⑦步中的过滤是高温下的过滤,设备必须能耐800℃的高温,故答案为:设备必须能耐800℃的高温;
(4)根据图中的部分物质的熔沸点,应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,要得到纯净的TiCl4,必须在136.4℃时收集,因为TiCl4沸点是136.4℃,Ti的沸点是:1660℃,第⑧步的真空电弧炉中的温度接近 1660℃,故答案为:蒸馏;136.4℃;1660℃;
(5)钛的还原性介于铝与锌之间,氧化铝是一层致密的氧化膜,估计钛能耐腐蚀的原因钛表面形成一层致密的氧化膜(或钛的内部结构紧密);活泼金属钠可以将金属钛置换出来:TiCl4+4Na
| ||
故答案为:钛表面形成一层致密的氧化膜(或钛的内部结构紧密);TiCl4+4Na
| ||
(6)Mg、Ti可以跟空气中O2、N2和CO2反应,防止生成的Mg、Ti的氧化物及氮化物导致制取的金属钛不纯,⑥⑦⑨三步操作需在稀有气体保护下进行,
故答案为:防止Mg、Ti跟空气中O2、N2和CO2反应生成Mg、Ti的氧化物及氮化物得不到高纯钛.
点评:本题综合考查学生实验的原理和设计方案的知识,注意知识的归纳和梳理是关键在,注重实验能力的培养,难度中等.

练习册系列答案
相关题目
下列可证明甲烷分子是正四面体结构的是( )
| A、一氯甲烷没有同分异构体 |
| B、二氯甲烷没有同分异构体 |
| C、三氯甲烷没有同分异构体 |
| D、甲烷分子的四个键完全相同 |
用NA表示阿伏伽德罗常熟的值.下列说法正确的是( )
| A、标准状况下,22.4LH2O中含有的分子数为NA |
| B、常温常压下,32gO2中含有的分子数为NA |
| C、1molMg与足量N2反应时转移的电子数为NA |
| D、1L1mol?L-1CaCl2溶液中含有的氯离子数为NA |
对于在一密闭容器中进行的下列反应:C(s)+O2(g)?CO2(g)下列说法中错误的是( )
| A、将木炭粉碎成粉末状可以加快化学反应速率 |
| B、升高温度可以加快化学反应速率 |
| C、增加压强不能加快化学反应速率 |
| D、增加木炭的量可以加快化学反应速率 |
有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份100mL溶液进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生.(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,以下推测错误的是( )
| A、K+一定存在 |
| B、每份取样溶液中含0.02mol CO32- |
| C、Cl-可能存在 |
| D、Ba2+一定不存在,Mg2+可能存在 |
常温下将pH=2的盐酸和pH=11的氢氧化钠溶液,以体积比1:9混合后,溶液的pH是( )
| A、3 | B、4 | C、9 | D、10 |
 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.
某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.