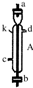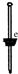题目内容
已知:H2S是一种无色具有臭鸡蛋气味的气体,易分解,能溶于水形成二元弱酸.某研究小组为研究H2S的性质进行了如下实验(已知FeS为黑色难溶于水的固体).
(1)制取H2S:
(1)写出实验I中反应的离子方程式 .并用沉淀溶解平衡原理解释FeS溶解于盐酸的过程 .
该小组同学对实验Ⅱ中产生的现象发生了兴趣,首先设计实验探究沉淀的成分.实验和现象:将实验Ⅱ产生的沉淀进行 、洗涤、干燥.将沉淀放在燃烧匙中,伸入广口瓶灼烧.燃烧后向广口瓶中滴加少量品红溶液,振荡.品红溶液褪色,褪色后的溶液加热后又恢复红色.可以推知该淡黄色沉淀为 ,写出沉淀燃烧产生刺激性气味气体的化学方程式 .
(2)探究生成沉淀的原因.
提出假设:①H2S不稳定,分解生成沉淀;② .
实验验证:
(3)重新假设并实验验证.
查阅资料:在Na2S溶液中经常含有多硫化钠(Na2Sx),多硫化钠稳定,但在酸的作用下生成不稳定的多硫化氢,多硫化氢分解生成硫.即:Sx2-+2H+═H2Sx H2Sx═H2S↑+(x-1)S
设计实验验证:
写出Na2S溶液暴露在空气里形成多硫化钠的化学方程式 .
(1)制取H2S:
| 编号 | 操作 | 现象 |
| Ⅰ |  | 反应剧烈,试管中的黑色固体逐渐溶解,产生大量的无色具有臭鸡蛋气味的气体. |
| Ⅱ | 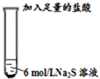 | 只有少量的无色臭鸡蛋气味的气体产生,但溶液中却有一定量的淡黄色沉淀产生. |
该小组同学对实验Ⅱ中产生的现象发生了兴趣,首先设计实验探究沉淀的成分.实验和现象:将实验Ⅱ产生的沉淀进行
(2)探究生成沉淀的原因.
提出假设:①H2S不稳定,分解生成沉淀;②
实验验证:
| 编号 | 操作 | 现象 |
| Ⅲ | 将H2S通入蒸馏水中达到饱和,将该溶液分为两等份.一份静置,另一份在空气中不断振荡. | 两份溶液在短时间内均未出现明显的浑浊现象. |
查阅资料:在Na2S溶液中经常含有多硫化钠(Na2Sx),多硫化钠稳定,但在酸的作用下生成不稳定的多硫化氢,多硫化氢分解生成硫.即:Sx2-+2H+═H2Sx H2Sx═H2S↑+(x-1)S
设计实验验证:
| 编号 | 操作 | 现象 |
| Ⅳ | 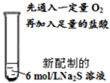 | 先通入一定量O2,几乎看不到明显变化;加入足量的盐酸,产生无色具有臭鸡蛋气味的气体,溶液中有大量的淡黄色沉淀产生. |
考点:性质实验方案的设计
专题:实验设计题
分析:(1)实验Ⅰ时是FeS中加入足量稀盐酸反应生成氯化亚铁和硫化氢气体,硫化亚铁为难溶固体;依据沉淀溶解 平衡影响因素分析判断沉淀溶解过程;固体通过过滤从溶液中分离出,洗涤干燥,淡黄色固体燃烧生成的气体可以使品红溶液褪色,证明是二氧化硫气体,则淡黄色固体为硫单质;
(2)酸性溶液中硫离子被空气中氧气氧化为硫单质;
(3)Na2S、氧气、水反应生成Na2S2、NaOH,以此书写方程式;
(2)酸性溶液中硫离子被空气中氧气氧化为硫单质;
(3)Na2S、氧气、水反应生成Na2S2、NaOH,以此书写方程式;
解答:
解:(1)实验Ⅰ时是FeS中加入足量稀盐酸反应生成氯化亚铁和硫化氢气体,硫化亚铁为难溶固体,反应的离子方程式为:FeS+2H+=Fe2++H2S↑;依据沉淀溶解 平衡影响因素分析判断沉淀溶解过程,硫化亚铁存在沉淀溶解平衡FeS(s)?Fe2++S2-,加入盐酸,氢离子结合硫离子生成硫化氢气体,促进平衡正向进行,硫化亚铁溶解;固体通过过滤从溶液中分离出,将实验Ⅱ产生的沉淀进行过滤、洗涤、干燥得到沉淀,淡黄色固体燃烧生成的气体可以使品红溶液褪色,证明是二氧化硫气体,反应的化学方程式为:S+O2
SO2 ;则淡黄色固体为硫单质;
故答案为:FeS+2H+=Fe2++H2S↑;硫化亚铁存在沉淀溶解平衡FeS(s)?Fe2++S2-,加入盐酸,氢离子结合硫离子生成硫化氢气体,促进平衡正向进行,硫化亚铁溶解;过滤,S,S+O2
SO2;
(2)将H2S通入蒸馏水中达到饱和,将该溶液分为两等份.一份静置,另一份在空气中不断振荡,两份溶液在短时间内均未出现明显的浑浊现象,但加入盐酸会出现硫化氢气体和硫单质,可能是硫化氢不稳定分解生成,也可能是酸溶液中硫离子被空气中氧气氧化生成硫单质;
故答案为:酸性溶液中硫离子被空气中氧气氧化为单质硫;
(3)Na2S、氧气、水反应生成Na2S2、NaOH,该反应的方程式为4Na2S+O2+2H2O═4NaOH+2Na2S2,故答案为:4Na2S+O2+2H2O═4NaOH+2Na2S2;
| ||
故答案为:FeS+2H+=Fe2++H2S↑;硫化亚铁存在沉淀溶解平衡FeS(s)?Fe2++S2-,加入盐酸,氢离子结合硫离子生成硫化氢气体,促进平衡正向进行,硫化亚铁溶解;过滤,S,S+O2
| ||
(2)将H2S通入蒸馏水中达到饱和,将该溶液分为两等份.一份静置,另一份在空气中不断振荡,两份溶液在短时间内均未出现明显的浑浊现象,但加入盐酸会出现硫化氢气体和硫单质,可能是硫化氢不稳定分解生成,也可能是酸溶液中硫离子被空气中氧气氧化生成硫单质;
故答案为:酸性溶液中硫离子被空气中氧气氧化为单质硫;
(3)Na2S、氧气、水反应生成Na2S2、NaOH,该反应的方程式为4Na2S+O2+2H2O═4NaOH+2Na2S2,故答案为:4Na2S+O2+2H2O═4NaOH+2Na2S2;
点评:本题考查了物质性质分析,实验工厂设计和物质检验方法和反应现象的理解应用,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下将pH=2的盐酸和pH=11的氢氧化钠溶液,以体积比1:9混合后,溶液的pH是( )
| A、3 | B、4 | C、9 | D、10 |
理论与事实相结合,是学习化学的重要方法,现有:FeS+2HCl=FeCl2+H2S↑,CuSO4+H2S=CuS↓+H2SO4,这二个反应在常温下都能进行.通过以上实验,下列结论可能不合理的( )
| A、CuS 不溶于强酸,FeS 可溶于强酸 |
| B、CuS 比FeS的溶解度更小 |
| C、H2S液中电离出的S2-浓度相当大 |
| D、转化成CuS是放热反应 |
一定温度下,对于反应N2+O2?2NO在密闭容器中进行,下列措施能加快反应速率的是( )
| A、改变温度 |
| B、恒容,充入N2 |
| C、恒容,充入He气 |
| D、恒压,充入He气 |

 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.
某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.

 ,又能发生银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有
,又能发生银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有