题目内容
15.已知单位体积的溶液中,难挥发性溶质的分子或离子数越多,该溶液的沸点越高,则下列溶液的沸点最高的是( )| A. | 2L 0.01mol/L的蔗糖溶液 | B. | 2L 0.01mol/L的CaCl2溶液 | ||
| C. | 1L 0.02mol/L的NaCl溶液 | D. | 1L 0.02mol/L的CH3COOH溶液 |
分析 根据溶液中难挥发性溶质的分子或离子数越多,该溶液的沸点就越高,则假设溶液为1L时计算选项中溶质的物质的量来比较即可解答.
解答 解:A、0.01mol/L的蔗糖溶液中主要是分子,没有离子;
B、0.01mol/L的CaCl2溶液中离子总浓度为0.01mol/L×3=0.03mol/L;
C、0.02mol/L的NaCl溶液0.02mol/L×2=0.04mol/L;
D、因CH3COOH是弱电解质,溶液中主要存在分子;
显然C中含0.04mol/L离子,离子浓度最大,
故选:C.
点评 本题考察角度新颖,利用非挥发性溶质的分子或离子数来判断溶液的沸点高低,学生熟悉物质的量浓度的有关计算是解答的关键,并会判断挥发性物质来解答即可.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S:Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是( )
(1)CuSO4+Na2CO3:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
(2)CuSO4+Na2S:Cu2++S2-=CuS↓
下列几种物质的溶解度大小的比较中,正确的是( )
| A. | CuS<Cu(OH)2<CuCO3 | B. | CuCO3<Cu(OH)2<CuS | C. | CuS<CuCO3<Cu(OH)2 | D. | Cu(OH)2<CuCO3<CuS |
6.2006年11月23日中科院网报道,纳米Fe3O4晶体材料可以作为核磁共振造影增强剂,用于疾病的诊断和作为药物载体用于疾病的治疗.其制备过程如图,下列叙述合理 的是( )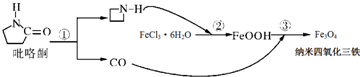

| A. | Fe3O4可以表示为FeO•Fe2O3,属于混合物 | |
| B. | 在反应②中FeCl3•6H2O被环丙胺(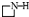 )还原为FeOOH )还原为FeOOH | |
| C. | 纳米四氧化三铁材料为胶体 | |
| D. | 反应③的化学方程式是:6FeOOH+CO═2Fe3O4+3H2O+CO2 |
3.氢化钠可以作为生氢剂(其中NaH中氢元素为-1价),反应方程式如下:NaH+H2O═NaOH+H2↑,则下列说法正确的是( )
| A. | 反应是置换反应,反应中有2个电子转移 | |
| B. | 反应是复分解反应 | |
| C. | 反应是氧化还原反应,反应中电子转移数为1 | |
| D. | 反应的离子方程式为H-+H+═H2↑ |
10.下列离子方程式书写正确的是( )
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸氢钠溶液中加入足量烧碱溶液:HSO4-+OH-═SO42-+H2O | |
| C. | Ba(OH)2与H2SO4反应到恰好沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 向澄清的石灰水中滴入少量碳酸氢钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
7.下列有关氧化还原反应的说法正确的是( )
| A. | 一定有电子得失或偏移 | B. | 氧化反应一定先于还原反应 | ||
| C. | 氧化剂发生氧化反应 | D. | 其实质是元素化合价发生变化 |
5.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,10.6g Na2CO3含有的Na+离子数为0.2 NA | |
| C. | 通常状况下,1 NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol•/L的MgCl2溶液中,含有Cl- 个数为1 NA |
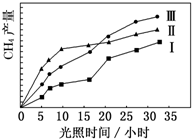 利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.
利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.