题目内容
10.下列离子方程式书写正确的是( )| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸氢钠溶液中加入足量烧碱溶液:HSO4-+OH-═SO42-+H2O | |
| C. | Ba(OH)2与H2SO4反应到恰好沉淀完全:Ba2++OH-+SO42-+H+═BaSO4↓+H2O | |
| D. | 向澄清的石灰水中滴入少量碳酸氢钠溶液:Ca2++OH-+HCO3-═CaCO3↓+H2O |
分析 A.碳酸钙不溶于水,应写成化学式;
B.HSO4-电离成氢离子和硫酸根离子;
C.不符合反应的配比数;
D.向澄清的石灰水中滴入少量碳酸氢钠溶液生成碳酸钙和水.
解答 解:A.碳酸钙不溶于水,应写成化学式,离子方程式为CaCO3+2H+═CO2↑+H2O+Ca2+,故A错误;
B.HSO4-电离成氢离子和硫酸根离子,应为H++OH-═H2O,故B错误;
C.不符合反应的配比数,应为Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故C错误;
D.向澄清的石灰水中滴入少量碳酸氢钠溶液生成碳酸钙和水,离子方程式为Ca2++OH-+HCO3-═CaCO3↓+H2O,故D正确.
故选D.
点评 本题考查离子反应的书写,为高频考点,把握发生的化学反应为解答的关键,注意电子、电荷守恒及离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
20.酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:溶解度/(g/100g水)
回答下列问题:
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+2MnO2+Zn+2H+=2MnOOH+Zn2+.
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、MnOOH和碳粉,欲从中得到较纯的MnO2,最简便的方法是在空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+$\frac{1}{x}$Sx(s)△H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+$\frac{3}{x}$Sx(s)△H=b kJ/mol.
则CO与Sx生成COS反应的热化学方程式是xCO(g)+Sx(s)=xCOS(g)△H=-0.5x(b-a)kJ/mol.
| 温度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 45.8 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 452 | 488 | 614 |
(1)该电池的正极反应式为MnO2+H++e-=MnOOH,电池反应的离子方程式为2MnO2+Zn+2H+=2MnOOH+Zn2+2MnO2+Zn+2H+=2MnOOH+Zn2+.
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn0.05g.(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过加热浓缩、冷却结晶分离回收;滤渣的主要成分是MnO2、MnOOH和碳粉,欲从中得到较纯的MnO2,最简便的方法是在空气中加热,其原理是碳粉转变为二氧化碳,MnOOH氧化为二氧化锰.
(4)已知25℃时:SO2(g)+2CO(g)=2CO2(g)+$\frac{1}{x}$Sx(s)△H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+$\frac{3}{x}$Sx(s)△H=b kJ/mol.
则CO与Sx生成COS反应的热化学方程式是xCO(g)+Sx(s)=xCOS(g)△H=-0.5x(b-a)kJ/mol.
1.和下列离子反应方程式相对应的化学方程式正确的是( )
| A. | Cu2++2OH-═Cu(OH)2 CuCO3+2NaOH═Cu(OH)2↓+Na2CO3 | |
| B. | Ba2++SO42-═BaSO4↓ Ba(OH)2+H2SO4═BaSO4↓+2H2O | |
| C. | Ag++Cl-═AgCl↓ AgNO3+NaCl═AgCl↓+NaNO3 | |
| D. | Cu+2Ag+═Cu2++2Ag↓ Cu+2AgCl═2Ag+CuCl2 |
18.下列叙述中正确的是( )
| A. | H2SO4的摩尔质量是98 | |
| B. | 2 mol NO中含2 mol氮和2 molO | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 1 mol O2的体积是22.4L |
15.已知单位体积的溶液中,难挥发性溶质的分子或离子数越多,该溶液的沸点越高,则下列溶液的沸点最高的是( )
| A. | 2L 0.01mol/L的蔗糖溶液 | B. | 2L 0.01mol/L的CaCl2溶液 | ||
| C. | 1L 0.02mol/L的NaCl溶液 | D. | 1L 0.02mol/L的CH3COOH溶液 |
19.下列变化过程,属于放热反应的是( )
①Ba(OH)2•8H2O 与NH4Cl反应 ②酸碱中和 ③浓硫酸稀释 ④固体NaOH溶于水 ⑤硫在空气或氧气中燃烧.
①Ba(OH)2•8H2O 与NH4Cl反应 ②酸碱中和 ③浓硫酸稀释 ④固体NaOH溶于水 ⑤硫在空气或氧气中燃烧.
| A. | ②③④⑤ | B. | ②③④ | C. | ②⑤ | D. | ①③⑤ |
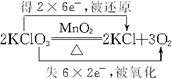 .
.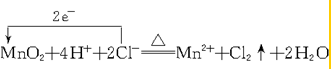 .
.