题目内容
4.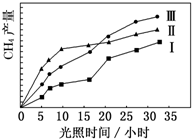 利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.
利用光能和光催化剂,可将 CO2 和 H2O(g)转化为 CH4 和 O2.紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示.(1)在0~30 小时内,CH4的平均生成速率 vⅠ、vⅡ和vⅢ从大到小的顺序为vⅢ>vⅡ>vⅠ;反应开始后的 12 小时内,在第II种催化剂作用下,收集的 CH4最多.
(2)将所得 CH4 与 H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g).该反应△H=+206kJ•mol-1.画出反应过程中体系能量变化图(进行必要标注).
分析 (1)相同时间甲烷的物质的量的变化量越大,表明平均速率越大,相同时间甲烷的物质的量的变化量越小,平均反应速率越小.由图2可知反应开始后的12小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多;
(2)CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的△H=+206kJ•mol-1,反应是吸热反应,反应物能量低于生成物能量;依据能量变化画出图象.
解答 解:(1)由图2可知,在0~30h内,甲烷的物质的量变化量为△n(Ⅰ)<△n(Ⅱ)<△n(Ⅲ),故在0~30h内,CH4的平均生成速率v(Ⅲ)>v(Ⅱ)>v(Ⅰ);
由图2可知反应开始后的12小时内,在第Ⅱ种催化剂的作用下,收集的CH4最多;
故答案为:vⅢ>vⅡ>vⅠ;Ⅱ.
(2)CH4(g)+H2O(g)?CO(g)+3H2(g),该反应的△H=+206kJ•mol-1,反应是吸热反应,反应过程中体系的能量变化图为: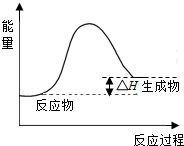 .
.
点评 本题考查了图象分析和画图象的方法,题目难度中等,注意图象信息的提取.

练习册系列答案
相关题目
14.10ml浓度为1mol/L的盐酸与过量的锌粉反应,若加入适量的下列物质,能加快反应速率但又不影响氢气生成的是( )
| A. | KNO3 | B. | CH3COONa | C. | CuSO4 | D. | Na2CO3 |
15.已知单位体积的溶液中,难挥发性溶质的分子或离子数越多,该溶液的沸点越高,则下列溶液的沸点最高的是( )
| A. | 2L 0.01mol/L的蔗糖溶液 | B. | 2L 0.01mol/L的CaCl2溶液 | ||
| C. | 1L 0.02mol/L的NaCl溶液 | D. | 1L 0.02mol/L的CH3COOH溶液 |
12.下列表示对应化学反应的离子方程式正确的是( )
| A. | 用Na与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 少量Ca(HCO3)2溶液与NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 石灰石溶于稀盐酸:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 铁与硫酸铜溶液反应:2Fe+3Cu2+═2Fe3++3Cu |
19.下列变化过程,属于放热反应的是( )
①Ba(OH)2•8H2O 与NH4Cl反应 ②酸碱中和 ③浓硫酸稀释 ④固体NaOH溶于水 ⑤硫在空气或氧气中燃烧.
①Ba(OH)2•8H2O 与NH4Cl反应 ②酸碱中和 ③浓硫酸稀释 ④固体NaOH溶于水 ⑤硫在空气或氧气中燃烧.
| A. | ②③④⑤ | B. | ②③④ | C. | ②⑤ | D. | ①③⑤ |
9.研究SO2、NOx等对改善空气质量具有重要意义.
(1)NOx是汽车尾气中的主要污染物之一.
①NOx能形成酸雨,由NO2形成的酸雨中含有的主要离子有H+、NO3-.
②汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是N2+O2═2NO.
(2)为减少SO2的排放,常采取一些有效措施.
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是CaSO4.
②下列物质中,可用于吸收烟气中的SO2的是ad(填序号).
a.Na2CO3 b.H2SO4 c.NaHSO3 d.NH3•H2O
(3)取某空气样本用蒸馏水处理制成待测液,其中所含的离子及其浓度如表:
根据表中数据计算:a=1×10-4 mol/L.
(1)NOx是汽车尾气中的主要污染物之一.
①NOx能形成酸雨,由NO2形成的酸雨中含有的主要离子有H+、NO3-.
②汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是N2+O2═2NO.
(2)为减少SO2的排放,常采取一些有效措施.
①在含硫煤中加入生石灰可以起到固硫的作用,燃烧过程中,硫元素转化成其最高价态的化合物,该化合物的化学式是CaSO4.
②下列物质中,可用于吸收烟气中的SO2的是ad(填序号).
a.Na2CO3 b.H2SO4 c.NaHSO3 d.NH3•H2O
(3)取某空气样本用蒸馏水处理制成待测液,其中所含的离子及其浓度如表:
| 离子 | K+ | Na+ | NH4+ | H+ | SO42- | NO3- | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | a | 4×10-5 | 3×10-5 | 2×10-5 |
16.氯气能使湿润的蓝色石蕊试纸( )
| A. | 褪色 | B. | 变成红色 | C. | 先褪色后变红 | D. | 先变红后褪色 |
13.下列各组实验中溶液最先变浑浊的是( )
| A. | 0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度10℃ | |
| B. | 0.1mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度10℃ | |
| C. | 0.1mol/LNa2S2O3和H2SO4各5mL,加水5mL,反应温度30℃ | |
| D. | 0.2mol/LNa2S2O3和H2SO4各5mL,加水10mL,反应温度30℃ |
14.粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙.以粗CuO为原料制备胆矾的主要流程如下:

经操作Ⅰ得到粗胆矾,操作Ⅲ得到精制胆矾.两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤.
已知:Fe3+、Fe2+、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
(1)溶解、过滤需要用到玻璃棒,它的作用是搅拌、引流.
(2)写出加入3% H2O2后发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.(原溶液显酸性).
(3)加稀氨水调节pH应调至范围3.7~5.2.下列物质可用来替代稀氨水的是BC.(填字母)
A.NaOHB.Cu(OH)2C.CuOD.NaHCO3
(4)操作Ⅲ析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、(NH4)2SO4 或NH4HSO4.
(5)某学生用操作Ⅲ所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
两次都无须再做第三次加热、冷却、称量,理由是已达恒重,该生此次实验的相对误差为+6.6%%(保留1位小数),产生实验误差的原因可能是AD(填字母).
A.加热前称量时坩埚未完全干燥B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却D.玻璃棒上沾有的固体未刮入坩埚.

经操作Ⅰ得到粗胆矾,操作Ⅲ得到精制胆矾.两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤.
已知:Fe3+、Fe2+、Cu2+转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| Fe3+ | Fe2+ | Cu2+ | |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
(2)写出加入3% H2O2后发生反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.(原溶液显酸性).
(3)加稀氨水调节pH应调至范围3.7~5.2.下列物质可用来替代稀氨水的是BC.(填字母)
A.NaOHB.Cu(OH)2C.CuOD.NaHCO3
(4)操作Ⅲ析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、(NH4)2SO4 或NH4HSO4.
(5)某学生用操作Ⅲ所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
| 第一次实验 | 第二次实验 | |
| 坩埚质量(g) | 14.520 | 14.670 |
| 坩埚质量+晶体质量(g) | 17.020 | 18.350 |
| 第一次加热、冷却、称量(g) | 16.070 | 16.989 |
| 第二次加热、冷却、称量(g) | 16.070 | 16.988 |
A.加热前称量时坩埚未完全干燥B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却D.玻璃棒上沾有的固体未刮入坩埚.