题目内容
在常温下,纯水中存在电离平衡H2O?H++OH-,如要使水的电离程度增大,并使溶液的pH减小,应加入的物质是( )
| A、Al2(SO4)3 |
| B、NaHSO4 |
| C、Na2CO3 |
| D、HCl |
考点:水的电离
专题:电离平衡与溶液的pH专题
分析:依据常温下水的电离平衡影响因素分析,加热促进水的电离,氢离子浓度增大;酸、碱抑制水的电离;水解的盐促进水的电离.
解答:
解:A、Al2(SO4)3=2Al3++3SO42-,溶液中铝离子水解促进水的电离,Al3++3H2O?Al(OH)3+3H+,溶液呈酸性c(H+)增大,溶液的pH减小,故A符合;
B、NaHSO4=Na++H++SO42-;溶液中的氢离子对水的电离起到抑制作用,故B不符合;
C、Na2CO3=2Na++CO32-,溶液中CO32-水解促进水的电离,CO32-+H2O?HCO3-+OH-,溶液呈碱性,c(H+)减小,溶液的pH增大,故C不符合;
D、HCl=H++Cl-,溶液中H+离子抑制水的电离,溶液呈碱性,c(H+)增大,溶液的pH减小,故D不符合;
故选A.
B、NaHSO4=Na++H++SO42-;溶液中的氢离子对水的电离起到抑制作用,故B不符合;
C、Na2CO3=2Na++CO32-,溶液中CO32-水解促进水的电离,CO32-+H2O?HCO3-+OH-,溶液呈碱性,c(H+)减小,溶液的pH增大,故C不符合;
D、HCl=H++Cl-,溶液中H+离子抑制水的电离,溶液呈碱性,c(H+)增大,溶液的pH减小,故D不符合;
故选A.
点评:本题考查了影响水的电离的因素分析,关键是酸碱抑制水的电离,能水解的盐促进水的电离,题目较简单.

练习册系列答案
 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案
相关题目
已知反应2I-+S2O82-═I2+2SO42-,加入淀粉溶液可观察到溶液变蓝色.反应速率可以用淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.20℃时得到如下实验数据:
分析上述数据,下列说法正确的是( )
| 实验编号 | C(I-)/mol?L | C(S2O82-)/mol?L | t/s |
| 1 | 0.040 | 0.040 | 88.0 |
| 2 | 0.080 | 0.040 | 44.0 |
| 3 | 0.080 | 0.080 | 22.0 |
| 4 | 0.160 | 0.020 | 44.0 |
| 5 | 0.120 | 0.040 | 29.3 |
| A、该实验的目的是研究 I- 与S2O82- 的浓度对反应速率的影响 |
| B、I-的浓度越大,反应速率越快 |
| C、S2O82- 的浓度越小,反应速率越快 |
| D、5个实验中,编号3对应浓度的实验,反应速率最快 |
水是最宝贵的资源之一.下列表述正确的是( )
A、H2O的电子式为 |
| B、4℃时,纯水的pH=7 |
| C、D216O中,质量数之和是质子数之和的两倍 |
| D、水分子在三种状态中,分子间的平均距离d:d(气态)>d(液态)>d(固态) |
实验是研究化学的基础,下列图中所示的实验方法、装置或操作中正确的是( )
A、 制备乙酸乙酯 制备乙酸乙酯 |
B、 测定中和热 |
C、 测定反应速率 |
D、 分离溴乙烷和水 |
BHT(Butylated Hydroxy Toluene)是一种常用的食品抗氧化剂,合成方法有如下两种下列说法错误的是( )
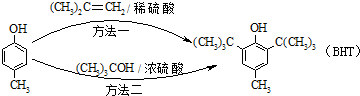

A、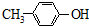 能与Na2CO3溶液反应 能与Na2CO3溶液反应 |
B、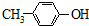 与BHT互为同系物 与BHT互为同系物 |
| C、BHT久置于空气中会被氧化 |
| D、两种方法的反应类型都是加成反应 |
一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响产生H2总量的是( )
①碳粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥水.
①碳粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥水.
| A、①③④ | B、①③⑤ |
| C、②④⑥ | D、③④⑤ |
下列说法正确的是( )
| A、蔗糖水解只生成葡萄糖 |
| B、含有碳碳双键的有机物均存在顺反异构现象 |
| C、向混有苯酚的苯中加入金属Na有无色气体生成 |
| D、用酸性高锰酸钾溶液检验CH2=CHCHO中是否含有醛基放电充电 |
