题目内容
一定量的锌粉和6mol/L的过量盐酸反应,当向其中加入少量的下列物质时,能够加快反应速率,但不影响产生H2总量的是( )
①碳粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥水.
①碳粉 ②CuO ③铜粉 ④铁粉 ⑤浓盐酸 ⑥水.
| A、①③④ | B、①③⑤ |
| C、②④⑥ | D、③④⑤ |
考点:化学反应速率的影响因素
专题:化学反应速率专题
分析:盐酸过量锌完全反应,锌的量决定氢气的体积,能够加快反应速率,又不影响产生H2的总量,采取措施有:形成原电池,注意形成原电池是不能消耗Zn,升高温度,改变锌粉的颗粒大小,增大氢离子的浓度等,以此来解答.
解答:
解:①加入碳粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故①正确;
②加入CuO,与盐酸反应生成氯化铜,氯化铜与锌反应生成铜,形成原电池,加快反应,但与盐酸反应的锌的量减少,生成氢气的总量减少,故②错误;
③加入铜粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故③正确;
④加入铁粉,构成原电池,反应速率加快,锌反应完毕,铁可以与盐酸反应生成氢气,产生H2的总量增大,故④错误;
⑤加入浓盐酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故⑤正确;
⑥加入水,氢离子浓度减小,反应速率减小,故⑥错误;
故选B.
②加入CuO,与盐酸反应生成氯化铜,氯化铜与锌反应生成铜,形成原电池,加快反应,但与盐酸反应的锌的量减少,生成氢气的总量减少,故②错误;
③加入铜粉,构成原电池,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故③正确;
④加入铁粉,构成原电池,反应速率加快,锌反应完毕,铁可以与盐酸反应生成氢气,产生H2的总量增大,故④错误;
⑤加入浓盐酸,氢离子浓度增大,反应速率加快,不影响锌粉的量,不影响产生H2的总量,故⑤正确;
⑥加入水,氢离子浓度减小,反应速率减小,故⑥错误;
故选B.
点评:本题考查化学反应速率的影响因素,为高频考点,把握常见的影响因素为解答的关键,注意加入氧化铜、Fe粉对氢气总量的影响是本题的易错点,题目难度不大.

练习册系列答案
 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
在常温下,纯水中存在电离平衡H2O?H++OH-,如要使水的电离程度增大,并使溶液的pH减小,应加入的物质是( )
| A、Al2(SO4)3 |
| B、NaHSO4 |
| C、Na2CO3 |
| D、HCl |
下列除杂方法正确的是( )
| A、用金属钠除去乙醇中混有的少量水 |
| B、用酸性KmnO4溶液除去甲烷中混有的少量乙烯 |
| C、用H2除去乙烷中混有的少量乙烯 |
| D、用饱和Na2CO3溶液除去乙酸乙酯中混有的少量乙醇和乙酸 |
下列说法正确的是( )
| A、水晶项链和卫生间地面的瓷砖都是硅酸盐制品 |
| B、用纯铝制造的高压锅更耐用 |
| C、玻璃是混合物,没有固定的熔点 |
| D、聚乙烯是热固性塑料,可用于制造电源插座 |
下列应急措施不正确的是( )
| A、少量浓硫酸溅到皮肤上时,立即用大量水冲洗 |
| B、误食入重金属盐时,立即喝足量牛奶紧急解毒 |
| C、金属钠着火时,立即用水浇灭 |
| D、发生一氧化碳中毒时,立即将中毒者移到通风处抢救 |
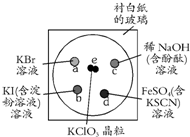 在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,下列叙述不正确的是( )
在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeSO4(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如图所示),在圆心处放置2粒芝麻大小的KClO3晶体,打开表面皿,向KClO3晶体滴加一滴浓盐酸,再立即将表面皿盖好,下列叙述不正确的是( )| A、b处无色碘化钾溶液先变蓝色后变为无色,体现氯气和HClO的漂白性 |
| B、a处无色溴化钾溶液渐变成橙黄色,说明氯的非金属性强于溴 |
| C、c处氢氧化钠酚酞溶液的红色渐渐褪去,可能体现HCl的酸性或HClO的漂白性 |
| D、d处硫酸亚铁溶液呈红色,说明氯气氧化性强于Fe3+ |
在FeBr2和FeI2混合溶液中逐渐通氯气,可能发生的反应的离子方程式是( )
| A、2Fe2++Cl2→2Fe3++2Cl - |
| B、2Fe2++2Br -+2I -+3Cl2→2Fe3++I2+Br2+6Cl - |
| C、2Fe2++4Br -+2I -+4Cl2→2Fe3++I2+2Br2+8Cl - |
| D、4Fe2++2Br -+2I -+4Cl2→4Fe3++I2+Br2+8Cl - |
用NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、0.5mol O2所含氧元素数为NA |
| B、0.2mol H2O所含的H原子数为0.2NA |
| C、0.1mol CH4所含电子数为NA |
| D、46克NO2和N2O4的混合物含有的分子数为NA |