题目内容
1. 氨气是一种重要的化工产品,在生产和科研中应用广泛,氨气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:
氨气是一种重要的化工产品,在生产和科研中应用广泛,氨气是工业合成氨的原料之一,工业上制取氨气有下列两种途径:途径一、用水和天然气作原料一步反应制得
途径二,用煤和水作原料经多步反应制得.
请回答下列问题:
(1)途径一反应的还原产物是氢气
(2)途径二中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
①上述反应达到平衡后,为提高CO的转化率,下列措施中正确的是BC(填写序号)
A.增大压强B.降低温度C.增大H2O(g)的浓度D.使用催化剂
②已知1000K时,上述反应的平衡常数K=0.627,若要使CO的转化率超过90%,则起始无中c(H2O):c(CO)不低于13.8.
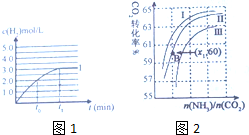
③在容积为2L的容器中发生上述反应,测得c(H)2与反应时间t的变化曲线Ⅰ如图1所示,若在t0时刻将容器的体积扩大至4L,请在答题卡图中绘出c(H2)与反应时间变化的曲线Ⅱ
(3)目前常用氨气处理硝酸生产的工业尾气,在400℃左右且有催化剂存在的情况下,氨气能把NO(g)还原成无色无毒气体,直接排入空气中,已知氢气的燃烧热为286kJ•mol-1
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1
试写出氨气与NO(g)反应生成五毒气体和液态水的热化学方程式4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=-2071.2kJ•mol-1
(4)工业上用氨和二氧化碳反应合成尿素,其反应为:2NH3(g)+CO2(g)?CO(NH2)2(l)+H2O(g)生成过程中,原料原料气常混有水蒸气,CO2的转化率与氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$、水碳比$\frac{n({H}_{2}O)}{n(C{O}_{2})}$的变化关系如图所示
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最小的是Ⅰ.
②若B点氨的转化率为60%,则x1=2.
(5)某同学将NH3和CO2按物质的量之比2:1通入水中,充分反应所得溶液中NH${\;}_{4}^{+}$、CO${\;}_{3}^{2-}$、HCO${\;}_{3}^{-}$ 三种离子浓度由大到小的顺序是c(NH4+)>c(CO32-)>c(HCO3-)(已知:氨水、碳酸的电离平衡常数如表)
| 弱电解质 | 化学式 | 电离常数(K) |
| 氨水 | NH3•H2O | 1.79×10-5 |
| 碳酸 | H2CO3 | K1=4.30×10-7 |
| K2=5.61×10-11 |
分析 (1)途径一是用水和天然气作原料一步反应制得氢气,根据化合价判断还原产物;
(2)①提高CO的转化率可以使平衡正向进行,根据化学平衡移动原理来回答判断;
②根据平衡常数用三段式法计算;
③体积增大2倍,浓度缩小2倍,压强变小,但压强对CO(g)+H2O(g)?CO2(g)+H2(g)的平衡无影响,所以达平衡时,氢气的浓度是原平衡的一半,据此画出c(H2)与反应时间变化的曲线Ⅱ;
(3)氢气的燃烧热为286KJ/mol指的是1mol氢气完全燃烧生成液态水时放热286KJ,燃烧热的热化学方程式必须保持可燃物为1mol,故热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286KJ/mol,再根据盖斯定律计算得出;
(4)①根据图2可知,氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的;②B点二氧化碳的转化率为60%,氨气的转化率是60%,设出NH3、CO2的起始物质的量,然后列式计算;
(5)将NH3和CO2按物质的量之比2:1通入水中,生成碳酸铵溶液,根据离子的水解程度比较溶液中c(NH4+)、c(CO32-)、c(HCO3-).
解答 解:(1)途径一是用水和天然气作原料一步反应制得氢气,氢的化合价降低,氢气作还原产物,故答案为:氢气;
(2)①提高CO的转化率可以让平衡正向进行即可:
A.增加压强,该平衡不会发生移动,故A错误;
B.降低温度,化学平衡向着放热方向即正向进行,故B正确;
C.增大水蒸气的浓度,化学平衡向着正方向进行,故C正确;
D.催化剂不会引起化学平衡的移动,故D错误;
故答案为:BC;
②设CO的起始浓度为xmol,H2O的起始浓度为ymol,则转化的CO的最小值为0.9x,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始 x y 0 0
变化 0.9x 0.9x 0.9x 0.9x
平衡 0.1x y-0.9x 0.9x 0.9x
根据平衡常数列式:$\frac{(0.9x)^{2}}{0.1x×(y-0.9x)}$=0.627,
解得:$\frac{y}{x}$=13.8,故此只要此值大于13.8,转化率就会超过90%,
故答案为:13.8;
③体积增大2倍,浓度缩小2倍,压强变小,但压强对CO(g)+H2O(g)?CO2(g)+H2(g)的平衡无影响,所以达平衡时,氢气的浓度是原平衡的一半,则c(H2)与反应时间变化的曲线Ⅱ: ;故答案为:
;故答案为: ;
;
(3)氢气的燃烧热为286kJ•mol-1,则氢气的燃烧的热化学方程式为:
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ•mol-1①
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1②
N2(g)+O2(g)?2NO(g)△H=+180kJ•mol-1③
根据盖斯定律①×6-②×2-③×3得4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=-2071.2kJ•mol-1,
故答案为:4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H=-2071.2kJ•mol-1;
(4)①根据图2可知,氨碳比一定时,水碳比越大,说明原料气中含二氧化碳越少,二氧化碳的转化率越低,所以二氧化碳转化率最低的即为水碳比最大的,则曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最小的是Ⅰ曲线,故答案为:Ⅰ;
②B点二氧化碳的转化率为60%,氨气的转化率是60%,
设NH3、CO2的起始物质的量分别为x、y,
则:x×60%×$\frac{1}{2}$=y×60%,
解得:$\frac{x}{y}$=x1=2,
故答案为:2;
(5)将NH3和CO2按物质的量之比2:1通入水中,生成碳酸铵溶液,铵根和碳酸根都水解,铵根的水解平衡常数Kh=$\frac{{K}_{W}}{{K}_{a}}$=$\frac{1{0}^{-14}}{1.79×1{0}^{-5}}$,碳酸根的水解平衡常数Kh=$\frac{{K}_{W}}{{K}_{a2}}$=$\frac{1{0}^{-14}}{5.61{×10}^{-11}}$,则碳酸根的水解程度大,铵根的水解程度小,溶液中的铵根浓度大于碳酸根,水解是弱水解,碳酸根的浓度大于碳酸氢根,则离子浓度大小关系为:c(NH4+)>c(CO32-)>c(HCO3-),故答案为:c(NH4+)>c(CO32-)>c(HCO3-).
点评 本题综合考查工业合成氨知识,涉及化学平衡、能量变化、盐类的水解等问题,侧重考查化学平衡移动在化学工艺中的应用以及化学平衡计算,题目难度较大.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| A. | 稀硫酸 | B. | 水 | C. | 溴水 | D. | 酸性高锰酸钾 |
| A. | SO32- | B. | SO42- | C. | S | D. | H2S |
| A. | 能加大反应速率、促进平衡向三氧化硫的方向移动 | |
| B. | 能提高二氧化硫的利用率、使原料不被浪费 | |
| C. | 能提高三氧化硫的平衡浓度 | |
| D. | 加大正逆反应速率,缩短达到平衡的时间 |
| A. | 除去苯中的苯酚,可加浓溴水使苯酚生成三溴苯酚沉淀,滤去 | |
| B. | 将苯酚晶体置适量水中,待苯酚溶解一部分成饱和溶液后,仍残留无色晶体 | |
| C. | 苯酚的酸性比碳酸弱,所以它不能溶于Na2CO3溶液里 | |
| D. | 苯酚也可与硝酸发生反应 |
| A. | 甲烷(丙烯):通入溴水 | |
| B. | 乙烷(乙烯):通入酸性高锰酸钾溶液 | |
| C. | CO2(SO2):气体通过盛氢氧化钠溶液的洗气瓶 | |
| D. | 乙醇(乙酸):加足量浓硫酸,蒸馏 |
| A. | 糖类、油脂和蛋白质都可以用来酿酒 | |
| B. | 工业酒精不能用来勾兑饮用酒水 | |
| C. | 葡萄糖转化为酒精的过程中放出热量 | |
| D. | 米酒储存不当容易变质发酸,原因是乙醇被氧化成乙酸 |