题目内容
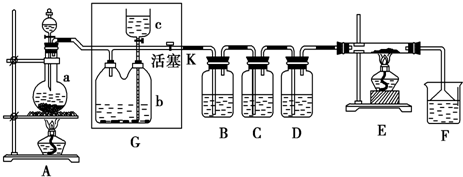
 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.(1)假设甲烷与氯气充分反应,且只产生一种有机物,请写出化学方程式
(2)经过几个小时的反应后,U型管右端的玻璃管中水柱变化是
A.升高 B.降低 C.不变 D.无法确定.
考点:实验装置综合
专题:实验题
分析:(1)甲烷与氯气反应充分,甲烷中的H完全被取代,只产生四氯化碳;
(2)甲烷和氯气反应后容器内压强变小,右端的玻璃管中水柱降低.
(2)甲烷和氯气反应后容器内压强变小,右端的玻璃管中水柱降低.
解答:
解:(1)甲烷与氯气反应充分,只产生四氯化碳,为取代反应,反应的化学方程式为CH4+4Cl2
CCl4+4HCl,故答案为:CH4+4Cl2
CCl4+4HCl;
(2)甲烷和氯气反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷和氯化氢是气体,氯化氢极易溶于水,使容器内压强变小,右端的玻璃管中水柱降低,故答案为:B.
| 光照 |
| 光照 |
(2)甲烷和氯气反应生成的二氯甲烷、三氯甲烷、四氯化碳均是油状的液体,只有一氯甲烷和氯化氢是气体,氯化氢极易溶于水,使容器内压强变小,右端的玻璃管中水柱降低,故答案为:B.
点评:本题考查实验装置综合,为高频考点,把握甲烷的取代反应及取代产物的性质为解答的关键,侧重分析及实验能力的考查,题目难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
根据气体的性质,推测利用如图装置,下列气体可制得的是( )


| A、NO2 |
| B、Cl2 |
| C、O2 |
| D、NH3 |
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气.
已知:N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
已知:N2(g)+2O2(g)=N2O4(g);△H=+8.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是( )
| A、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1076.7 kJ/mol | ||||
B、N2H4(g)+
| ||||
| C、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-542.7 kJ/mol | ||||
| D、2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g);△H=-1059.3 kJ/mol |
氢氧化镁悬浊液存在下列平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),下列有关说法不正确的是( )
| A、加少量水,更多的氢氧化镁溶解 |
| B、加少量NaOH(s),氢氧化镁的溶解量减少 |
| C、加少量氯化氢,溶液的pH变大 |
| D、加少量MgCl2(s),溶液的pH变小 |
下列说法正确的是( )
| A、难溶电解质的溶度积越小,溶解度越大 |
| B、可以通过沉淀反应使杂质离子完全沉淀 |
| C、难溶电解质的溶解达到平衡后就静止不动了 |
| D、一定浓度的NH4Cl溶液可以溶解Mg(OH)2 |