题目内容
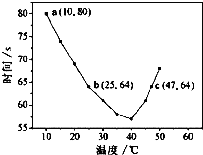 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A、40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B、温度高于40℃时,淀粉不宜用作该实验的指示剂 |
| C、图中a点对应的NaHSO3平均反应速率为2.5×10-4mol?L-1?s-1 |
| D、图中b、c两点对应的NaHSO3反应速率:b<c |
考点:探究温度、压强对化学反应速率的影响,氧化还原反应
专题:
分析:A.由图可知,40℃之前,温度高反应速率加快,40℃之后温度高,变色时间越长;
B.结合55℃时,没有出现蓝色分析;
C.a点时间为80s,浓度变化量为
=0.004mol/L;
D.b、c点对应的反应原理及温度判断.
B.结合55℃时,没有出现蓝色分析;
C.a点时间为80s,浓度变化量为
| 0.02mol/L×0.01L |
| 0.05L |
D.b、c点对应的反应原理及温度判断.
解答:
解:A.从图象中可以看出,40℃以前,温度越高,反应速度越快,40℃后温度越高,变色时间越长,反应越慢,而55℃,未变蓝,说明没有生成I2,故A正确;
B.55℃时,没有出现蓝色,故淀粉已不能作为该反应的指示剂,故B正确;
C.a点时间为80s,浓度变化量为
=0.004mol/L,a点对应的NaHSO3反应速率为5.0×10-5mol?L-1?s-1,故C错误;
D.b点的反应原理为:当碘酸钾过量时,生成碘单质,其离子反应式为5SO32-+2IO3-+2H+=5SO42-+I2+H2O,而图中c点的反应原理为2IO3-+5SO2+4H2O=5SO42-+I2+8H+,虽然图中b、c点对应的反应原理不一样,但温度b<c,故反应速率b<c,故B正确;
故选C.
B.55℃时,没有出现蓝色,故淀粉已不能作为该反应的指示剂,故B正确;
C.a点时间为80s,浓度变化量为
| 0.02mol/L×0.01L |
| 0.05L |
D.b点的反应原理为:当碘酸钾过量时,生成碘单质,其离子反应式为5SO32-+2IO3-+2H+=5SO42-+I2+H2O,而图中c点的反应原理为2IO3-+5SO2+4H2O=5SO42-+I2+8H+,虽然图中b、c点对应的反应原理不一样,但温度b<c,故反应速率b<c,故B正确;
故选C.
点评:本题考查化学反应速率的影响因素,侧重图象分析及温度对反应的影响,注意不同温度下均可被过量KIO3氧化,注重分析能力和解决问题能力的考查,题目难度较大.

练习册系列答案
相关题目
关于化学反应与能量的说法正确的是( )
| A、任何化学反应都伴随有能量变化 |
| B、△H>0表示放热反应,△H<0表示吸热反应 |
| C、化学键的断裂会放出能量 |
| D、反应物总能量比生成物总能量高的反应是吸热反应 |
对下列实验的评价,正确的是( )
| A、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| C、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、验证烧碱溶液中是否含有Cl-,先加稍过量的稀硝酸除去OH-,再加入AgNO3溶液,如有白色沉淀,则证明有Cl- |
根据气体的性质,推测利用如图装置,下列气体可制得的是( )


| A、NO2 |
| B、Cl2 |
| C、O2 |
| D、NH3 |
氢氧化镁悬浊液存在下列平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),下列有关说法不正确的是( )
| A、加少量水,更多的氢氧化镁溶解 |
| B、加少量NaOH(s),氢氧化镁的溶解量减少 |
| C、加少量氯化氢,溶液的pH变大 |
| D、加少量MgCl2(s),溶液的pH变小 |
全部属于纯净物的组合是( )
| A、福尔马林、白酒、食醋 |
| B、汽油、油脂、酚醛树脂 |
| C、石碳酸、盐酸、冰醋酸 |
| D、甘油、乙醇钠、氯仿 |