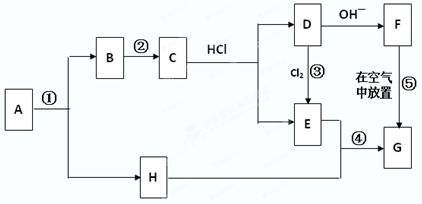
题目内容
在中和滴定操作中,有以下各项因操作不当而引起的实验误差,用“偏高”、“偏低”或“无影响”等填空:
(1)滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果 .
(2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,是滴定结果 .
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果 .
(4)滴定前平视,滴定终点俯视,使滴定结果 .
(5)用NaOH溶液滴定盐酸(酚酞作指示剂),当加入一滴NaOH溶液时溶液呈浅红色,此时便停止滴定,使滴定结果 .
(6)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 .
(7)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度 .
(8)洗涤锥形瓶时,误把稀食盐水当作蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果 .
(1)滴定管用蒸馏水洗净后,未用已知浓度的标准溶液润洗,使滴定结果
(2)锥形瓶用蒸馏水洗净后,又用待测溶液润洗,是滴定结果
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果
(4)滴定前平视,滴定终点俯视,使滴定结果
(5)用NaOH溶液滴定盐酸(酚酞作指示剂),当加入一滴NaOH溶液时溶液呈浅红色,此时便停止滴定,使滴定结果
(6)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度
(7)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度
(8)洗涤锥形瓶时,误把稀食盐水当作蒸馏水,然后用锥形瓶装待测的盐酸,用NaOH标准溶液滴定时,对测得的结果
考点:中和滴定
专题:实验评价题
分析:根据c(待测)=
,分析不当操作对V(标准)的影响,以此判断浓度的误差.
| c(标准)×V(标准) |
| V(待测) |
解答:
解:(1)未用标准液润洗酸式滴定管就直接注入标准酸液,造成V(标准)偏大,所以c(待测)偏高,故答案为:偏高;
(2)将锥形瓶用待测液润洗,造成V(标准)偏大,所以c(待测)偏高,故答案为:偏高;
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,造成V(标准)偏大,所以c(待测)偏高,故答案为:偏高;
(4)滴定前平视、滴定后俯视读数,造成V(标准)偏小,所以c(待测)偏小,故答案为:偏低;
(5)滴定过程中,当加入一滴NaOH溶液时溶液呈浅红色,此时便停止滴定,记录读数,造成V(标准)偏小,c(标准)偏小,故答案为:偏低;
(6)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,造成V(标准)偏小,c(标准)偏小,故答案为:偏低;
(7)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,造成V(标准)偏大,所以c(待测)偏高,故答案为:偏高;
(8)洗涤锥形瓶时,误把稀食盐水当作蒸馏水,所取待测液的量没变,故不影响V(标准),所以滴定结果无影响,故答案为:无影响.
(2)将锥形瓶用待测液润洗,造成V(标准)偏大,所以c(待测)偏高,故答案为:偏高;
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,造成V(标准)偏大,所以c(待测)偏高,故答案为:偏高;
(4)滴定前平视、滴定后俯视读数,造成V(标准)偏小,所以c(待测)偏小,故答案为:偏低;
(5)滴定过程中,当加入一滴NaOH溶液时溶液呈浅红色,此时便停止滴定,记录读数,造成V(标准)偏小,c(标准)偏小,故答案为:偏低;
(6)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,造成V(标准)偏小,c(标准)偏小,故答案为:偏低;
(7)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,造成V(标准)偏大,所以c(待测)偏高,故答案为:偏高;
(8)洗涤锥形瓶时,误把稀食盐水当作蒸馏水,所取待测液的量没变,故不影响V(标准),所以滴定结果无影响,故答案为:无影响.
点评:分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.

练习册系列答案
相关题目
NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、含0.1 mol BaCl2的溶液中Cl-数为0.2 NA |
| B、22 g CO2所含有的分子数为0.5 NA |
| C、11.2L CO2所含有的分子数为0.5 NA |
| D、常温下NA 个Cl2分子所占有的体积为22.4L |
用NA表示阿伏伽德罗常数,下列叙述不正确的是( )
| A、标准情况下,22.4LH2含有的分子数为1NA |
| B、常温常压下,1.06gNa2CO3(相对分子质量为106)含有的Na+离子数为0.02NA |
| C、常温常压下,6.02×1023个CO2分子占有的体积为22.4L |
| D、1L物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1NA |
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB-,②HB-?H++B2-,则下列说法中一定正确的是( )
| A、Na2B溶液中一定有:c(Na+)=2[c(B2-)+c(HB-)+c(H2B)] |
| B、Na2B溶液一定呈碱性,NaHB溶液可能呈酸性也可能呈碱性 |
| C、NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB-)+c(OH-)+c(B2-) |
| D、在Na2B溶液中一定有:c(OH-)=c(H+)+c(HB-) |
工业上用洗净的废铜屑作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采取的方法是( )
| A、Cu+HNO3 (浓)→Cu (NO3)2 | ||||
| B、Cu+HNO3 (稀)→Cu (NO3)2 | ||||
C、Cu
| ||||
D、Cu
|
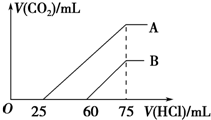 向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份NaOH溶液中,分别通入一定量的CO2后,再稀释到100mL.