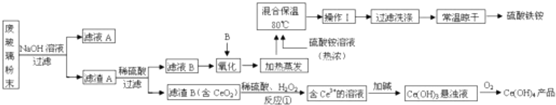
题目内容
工业上用洗净的废铜屑作原料来制备硝酸铜.为了节约原料和防止污染环境,宜采取的方法是( )
| A、Cu+HNO3 (浓)→Cu (NO3)2 | ||||
| B、Cu+HNO3 (稀)→Cu (NO3)2 | ||||
C、Cu
| ||||
D、Cu
|
考点:化学实验方案的评价
专题:
分析:节约原料,说明使用的反应物量少,能防止污染环境,说明该反应中没有有毒气体产生,据此分析解答.
解答:
解:A.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,二氧化氮有毒而污染环境,所以不符合条件,故A不选;
B.3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,NO有毒会污染环境,所以不符合条件,故B不选;
C.2 Cu+O2
2CuO、CuO+2HNO3=Cu(NO3)2+H2O,该反应中没有有毒气体生成,且能节约硝酸,所以符合条件,故C选;
D.Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O、CuSO4+Ba(NO3)2=BaSO4↓+Cu(NO3)2,该过程中生成有毒气体二氧化硫且浪费浓硫酸、硝酸钡,所以不符合条件,故D不选;
故选C.
B.3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,NO有毒会污染环境,所以不符合条件,故B不选;
C.2 Cu+O2
| ||
D.Cu+2H2SO4(浓)
| ||
故选C.
点评:本题考查实验方案评价,明确反应条件、反应物的量、反应生成物的性质即可解答,要注意结合节约、环保理念分析解答,题目难度不大.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案
相关题目
 美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).
美国有个已经破产了的铱星公司,原来计划发射77颗卫星以实现全球卫星通讯,其公司名称和发射卫星计划数目取材于元素周期表中的铱元素(如图所示).以下说法正确的是( )
| A、铱原子核外有77个电子 |
| B、铱元素的原子构成了一种非金属化合物 |
| C、铱原子核中有192个中子 |
| D、铱元素的相对原子质量为77 |
下列几种类推结论中,正确的是( )
| A、由2Cu+O2═2CuO可推出同族的硫也有Cu+S═CuS |
| B、Fe3O4可表示为FeO?Fe2O3,则Pb3O4可表示为PbO?Pb2O3 |
| C、Na能与水反应生成H2,K、Ca也能与水反应生成H2 |
| D、CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应只生成Na2SO3和O2 |
下列关于有机物的说法正确的是( )
| A、乙烯和苯都能使溴水褪色,褪色的原因不相同 |
| B、苯中少量的苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤而除去 |
| C、苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 |
| D、乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
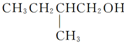 在Ag存在和加热条件下与O2反应的化学方程式:
在Ag存在和加热条件下与O2反应的化学方程式: